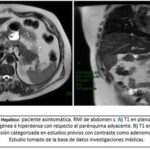
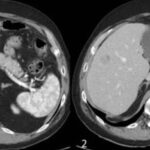
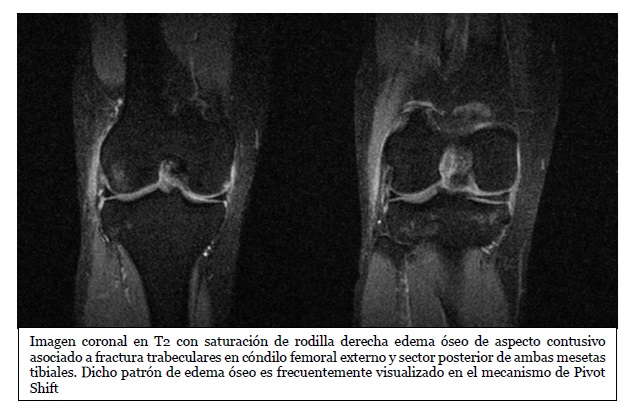
Autora: Dra. Dalinda Pierina Bilbao Rodríguez
Directora de la carrera: Dra. Marta Kura
Tutor: Dr. Sebastián Párez Espinoza
Resumen
En el siguiente documento vamos a evaluar las características imagenológicas y descripción de lesiones hepáticas benignas, como quistes hepáticos, hemangiomas, hiperplasia nodular focal y adenomas hepáticos, y malignas, como hepatocarcinoma, colangiocarcinoma, hepatocarcinoma fibromelar y metástasis, con el objetivo principal de visualizar y remarcar la incidencia de estas lesiones hepáticas mediante tomografía computada (TC), por medio de la revisión de casos clínicos observados en el Hospital General de Agudos José María Ramos Mejía entre 2022 y 2024. El trabajo aborda la importancia del diagnóstico por imágenes en la detección y clasificación de la lesiones hepáticas antes mencionadas.
La metodología incluyó la revisión de estudios de pacientes entre febrero de 2022 y agosto de 2024, detallando los criterios de inclusión y exclusión. En el análisis se describe la anatomía hepática relevante y se emplea el sistema de clasificación LI-RADS para estandarizar el reporte y la interpretación de imágenes hepáticas en pacientes con riesgo de desarrollar carcinoma hepatocelular.
Entre los hallazgos destaca la efectividad del uso de TC multidetector para una caracterización detallada de las lesiones, y se resalta el uso de contraste para realzar la imagen al momento de hacer el estudio para mayor visualización de la lesión y poder evaluar la funcionalidad hepática y la estructura biliar. El trabajo concluye con recomendaciones sobre los métodos de diagnóstico y enfatiza en la importancia de estos para el abordaje clínico y el tratamiento de las lesiones hepáticas.
Palabras clave: lesiones hepáticas, focales, ecografía, tomografía, resonancia magnética, incidentalomas.
Introducción
La lesión focal hepática está definida como una formación de contenido sólido o líquido que no forma parte de la anatomía normal del hígado. Su aparición es muy común en el adulto joven y mayor, y afecta por igual a ambos sexos. Muchas de estas patologías producen síntomas inespecíficos, como dolor en hipocondrio derecho, ictericia obstructiva, fiebre o compresión de órganos vecinos. El riesgo de complicación y malignización es muy bajo, siendo más frecuente en algunos tipos histológicos y en los de mayor tamaño.
El término “tomografía” viene de la palabra griega tomos, que significa “cortar o dividir”, y es precisamente esto lo que ocurre durante el procedimiento: el equipo de tomografía axial computarizada obtiene imágenes seccionales en los tres diferentes planos anatómicos; las imágenes son obtenidas por un conjunto de detectores y llevadas a un ordenador que mediante un complejo sistema hace posible la visualización de la región anatómica estudiada, aun así estas lesiones hepáticas representan un desafío diagnóstico importante debido a la diversidad de sus características y la complejidad de su identificación precisa. En el contexto de la radiología, la tomografía computada (TC) se utiliza frecuentemente para la detección y caracterización de estas lesiones. Sin embargo, la distinción entre lesiones benignas y malignas en imágenes de TC puede ser compleja, por lo cual debe aplicarse una buena observación y descripción de las lesiones para evitar afectar decisiones clínicas críticas.
A pesar de los avances en la tecnología de imagen, se carece de estudios específicos que describan las características imagenológicas y la incidencia de estas lesiones en poblaciones hospitalarias específicas, como es la del Hospital General de Agudos José María Ramos Mejía. Esto limita la capacidad de los profesionales para tomar decisiones fundamentadas en datos locales y reales de su entorno, lo que podría influir en la precisión del diagnóstico y en la planificación terapéutica de los pacientes, por lo que se plantea la elaboración de una investigación descriptiva y observacional donde se evalúen las incidencias de pacientes que presenten lesiones hepáticas benignas y malignas en el Hospital General de Agudos José María Ramos Mejía.
Diagnóstico
El estudio aborda un tema de interés en el Hospital General de Agudos José María Ramos Mejía, se observa una frecuencia notable de pacientes con lesiones hepáticas diagnosticadas mediante tomografía computada (TC), por sospecha y muchas de estas se hallaron de manera incidental, en el período comprendido entre 2022 y 2024. Durante este lapso se proporcionó atención médica por medio del Servicio de Diagnóstico por Imágenes del hospital a un amplio espectro de pacientes, y en este estudio tendremos en consideración una muestra de 550 pacientes con distintos resultados, los cuales abarcan tanto lesiones benignas como malignas. Sin embargo, la caracterización precisa de estas lesiones representa un desafío considerable, ya que muchas de ellas tienen características imagenológicas similares, lo que dificulta la distinción entre etiologías benignas y malignas.
Dentro de las herramientas diagnósticas empleadas se hizo uso del tomógrafo CANON (Aquilion) Lightning que genera 16 cortes por rotación para la visualización de las lesiones encontradas en los 540 pacientes que hicieron parte de este estudio. Estas pruebas son material de importancia en el proceso de diagnóstico y seguimiento, las cuales han sido interpretadas por médicos especialistas en diagnóstico por imágenes.
El objetivo primordial de esta investigación es realizar un análisis descriptivo y observacional de pacientes con diagnósticos de lesiones hepáticas focales, con el fin de determinar la incidencia de esta patología sobre la base de su benignidad o malignidad. Además busca detallar y analizar las características radiológicas detectadas en tomografía haciendo uso de las directrices del sistema LI-RADS como referencia para la categorización de los hallazgos.
La realización de esta investigación detallada sobre las características imagenológicas de las lesiones hepáticas en la población atendida en el hospital es esencial, ya que la variabilidad de presentación y el contexto específico del hospital pueden influir en las características observadas en las imágenes de TC, de modo que este análisis tiene el potencial de mejorar la comprensión de estas patologías en la población local y de optimizar el proceso diagnóstico y terapéutico en este contexto clínico específico.
Objetivos
Objetivo general
Determinar la incidencia de lesiones focales hepáticas benignas y malignas en pacientes sometidos a tomografía computarizada en el Hospital General de Agudos José María Ramos Mejía, durante el período comprendido entre febrero de 2022 y agosto de 2024.
Objetivos particulares
- Establecer la incidencia de lesiones hepáticas en pacientes que se sometieron a tomografía computada entre febrero de 2022 y agosto de 2024.
- Identificar y describir las características radiológicas más comunes en tomografía computada en pacientes con lesiones hepáticas, y asociarlas con las características descritas en la bibliografía médica actual.
- Determinar las lesiones hepáticas más encontradas en los pacientes que se sometieron a tomografía computada entre febrero de 2022 y agosto de 2024 en el Hospital General de Agudos José María Ramos Mejía.
- Comprobar el uso del sistema LI-RADS en la clasificación e identificación de lesiones hepáticas para optar por un mejor enfoque terapéutico para el paciente.
- Evaluar el uso de la tomografía computada como una herramienta diagnóstica clave para el diagnóstico y terapéutica de los pacientes con lesiones hepáticas.
Marco teórico y antecedentes
Anatomía del hígado
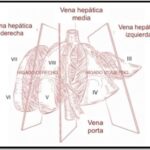
El hígado es un órgano multifuncional, de fisiología compleja, destacando sus funciones vasculares (de almacenamiento de hasta el 10% del volumen circulante de sangre y de filtración sinusoidal mediante el rol de las Macrophagocytus stellatus o células de Kupffer); metabólicas, propias del rol de los hepatocitos en el metabolismo de proteínas, grasas e hidratos de carbono y otros; y secretoras y excretoras (encargadas de la formación de bilis). Sitio potencial de lesiones tumorales quísticas y sólidas, benignas y malignas (primarias y secundarias), razón por la cual, conocer su anatomía radiológica y quirúrgica es muy relevante.
Es una víscera maciza, cuyo peso oscila entre 1,4 y 1,8 kg en el hombre y entre 1,2 y 1,4 kg en la mujer. Se encuentra casi en su totalidad cubierta por las costillas, excepto a nivel del epigastrio. Se halla sujeto a la pared abdominal por medio de elementos de fijación (ligamentos redondos que contiene la vena umbilical, suspensorio, coronales y triangulares derecho e izquierdo; ligamento hepatogástrico y hepatoduodenal; a los que se ha de agregar la vena cava y el pedículo hepático, compuesto por la vena porta, la arteria hepática propia y el conducto colédoco).(1)
Su irrigación depende en un 75% de la vena porta, y en el 25% restante, de la arteria hepática. Sin embargo, existen variantes frecuentes: Michels I (55%), caracterizado por una arteria hepática que nace del tronco celíaco dando dos arterias, gastroduodenal y hepática propia, que posteriormente se divide en derecha e izquierda; Michels II (10%), caracterizado por una arteria hepática izquierda que nace de la arteria gástrica izquierda; Michels III (11%), caracterizado por una arteria hepática derecha que se origina en la arteria mesentérica superior; Michels IV (11%), la arteria hepática izquierda nace de la arteria gástrica izquierda y la arteria hepática derecha se origina en la arteria mesentérica superior; Michels V (8%), en que la arteria hepática común da sus ramas (derecha e izquierda), existiendo otra accesoria para el lóbulo izquierdo, que se origina en la arteria gástrica izquierda; Michels VI (7%), la arteria hepática común da sus ramas derecha e izquierda, existiendo otra accesoria para el lóbulo derecho, que se origina en la arteria mesentérica superior; Michels VII (1%), que combina los tipos V y VI; Michels VIII (4%), el lóbulo derecho es irrigado por una arteria proveniente de la mesentérica superior, y el lóbulo izquierdo por dos ramas: una proveniente de la arteria hepática común y otra de la arteria gástrica izquierda; Michels IX (4,5%), en que la arteria hepática común se origina en la arteria mesentérica superior; Michels X (0,5%), en que la arteria hepática común se origina en la arteria gástrica izquierda(1) (ver Anexo 1).
Bases anatómicas de las resecciones hepáticas
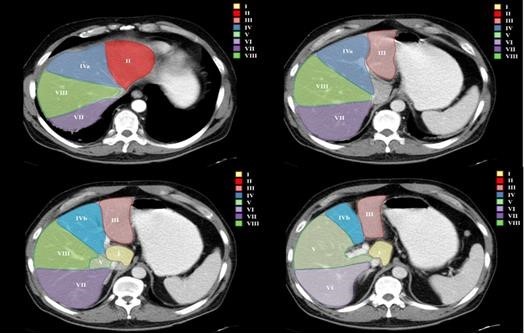
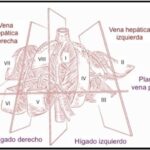
Los VIII segmentos anatómicos hepáticos están definidos por la organización de los sistemas venosos hepático y portal (ver Anexos 2 y 3). Asimismo, cada segmento tiene un flujo circulatorio y drenaje biliar independiente. Por tal motivo es posible eliminar uno o más segmentos y aun así no interrumpir el flujo sanguíneo ni biliar de los demás segmentos.(1)
El hígado se puede dividir en cuatro secciones: la sección anterior derecha (segmentos V y VIII), sección posterior derecha (segmentos VI y VII), sección medial izquierda (segmento IV) y sección lateral izquierda (segmentos II y III) (ver Anexo 4).
Epidemiología
A nivel global las lesiones hepáticas benignas, como en el caso de los quistes hepáticos, hemangiomas, hiperplasia nodular focal (FNH) y adenomas hepáticos, varían según la población y los métodos de detección utilizados. Un estudio que evaluó a 45.319 pacientes hospitalarios en Estados Unidos mediante ecografía y tomografía computada, encontró que las lesiones hepáticas benignas son comunes, con una prevalencia del 15,1% en la población estudiada. Los quistes hepáticos fueron la primera lesión más común, con una prevalencia del 5,8%, seguidos por los hemangiomas hepáticos, con un 3,3%. La FNH y los adenomas hepáticos fueron menos frecuentes, con prevalencias de 0,2% y 0,04%, respectivamente.(2)
La FNH es el tumor benigno no vascular más común del hígado y se encuentra típicamente en mujeres asintomáticas. Se cree que surge como una respuesta hiperplásica a un flujo sanguíneo localmente alterado. Por otro lado, los adenomas hepáticos son tumores benignos raros, sobre todo en mujeres jóvenes que usan anticonceptivos que contienen estrógenos, y pueden complicarse con sangrado espontáneo o transformación maligna.(3)
En la Argentina, la prevalencia y características de estas lesiones pueden ser similares a las observadas en otras poblaciones debido a factores comunes, como el uso de técnicas de imagen avanzadas y la exposición a anticonceptivos orales. Es importante considerar que la detección incidental de estas lesiones ha aumentado con el uso generalizado de modalidades de imagen de alta resolución.(3)
Por otro lado, cuando hablamos de las lesiones hepáticas malignas, específicamente del carcinoma hepatocelular (HCC), el colangiocarcinoma, el carcinoma fibromelar y las metástasis hepáticas, presentan variaciones significativas a nivel mundial y en Argentina.
El carcinoma hepatocelular (HCC) es el tipo más común de cáncer de hígado primario, representando entre el 75% y el 85% de los casos de cáncer hepático primario. A nivel mundial, se estima que hubo aproximadamente 725.000 nuevos casos de HCC en 2020, con una alta incidencia en regiones como Asia-Pacífico, donde la infección por el virus de la hepatitis B (HBV) es un factor de riesgo predominante.(4) En América del Sur, incluyendo Argentina, el HCC es también una preocupación significativa, con la hepatitis C (HCV) y la cirrosis alcohólica como factores de riesgo principales.(5)
El colangiocarcinoma intrahepático (iCCA) es el segundo tipo más común de cáncer hepático primario, con una incidencia global estimada de 123.000 casos en 2018. Las tasas más altas de iCCA se observan en el sudeste asiático, debido a factores como la infestación por parásitos hepáticos.(6-7) El carcinoma fibromelar es una forma rara de HCC que afecta principalmente a jóvenes sin enfermedad hepática subyacente. Su incidencia es baja, representando entre el 0,5% y el 0,9%.
Las metástasis hepáticas son más comunes que los tumores hepáticos primarios y suelen originarse de cánceres gastrointestinales, de mama, pulmón y páncreas. La incidencia de metástasis hepáticas refleja la carga global de estos cánceres primarios y su capacidad para diseminarse al hígado principalmente (Anexo 5).
Factores de riesgo
Se conocen muchos factores de riesgo que se encuentran estrechamente relacionados con el aumento de la incidencia y de la mortalidad del CHC:
- Edad: (> 70 años).
- Sexo masculino.
- Cirrosis hepática.
- Infección crónica por VHB.
- Infección crónica por VHC.
- Intoxicación por aflatoxina B1.
- Radiación ionizante.
- Glucemia elevada/diabetes mellitus tipo 2.
- Síndrome metabólico/obesidad.
- Hígado graso.
- Esteatohepatitis no alcohólica.
- Anomalías genéticas: deficiencia de alfa-1 antitripsina, tirosinemia, galactosemia y fructosita.
- Predisposición genética.
- Hormonas anabolizantes.
- Anticonceptivos estrogénicos.
- Enfermedad de Wilson en presencia de cirrosis.
Grupo étnico
Existen variaciones geográficas y étnicas significativas en la incidencia del CHC. Las poblaciones de alto riesgo se agrupan en África subsahariana y Asia oriental, donde es frecuente la infección crónica por el virus de la hepatitis B (VHB). También se observan diferencias étnicas en la incidencia de cáncer de hígado dentro de las mismas regiones geográficas, lo que sugiere interacciones genéticas y ambientales.(8-9)
Edad
El riesgo de desarrollar CHC aumenta con la edad. En regiones de alta incidencia, la edad pico de CHC suele ser entre 40 y 60 años, mientras que en regiones de baja incidencia suele ser mayor. Los aumentos relacionados con la edad en el riesgo de CHC probablemente se deban a la exposición acumulada a factores de riesgo, como la hepatitis viral crónica y la cirrosis.(8-10)
Toxinas alimenticias
La exposición a las aflatoxinas, principalmente a través de la ingestión de alimentos mohosos, es un factor de riesgo significativo para el CHC, en particular en África subsahariana y Asia. Las aflatoxinas potencian sinérgicamente los efectos cancerígenos del VHB. Otras toxinas dietéticas, como el arsénico inorgánico y ciertos contaminantes alimentarios, también se han implicado en la carcinogénesis hepática,(8-9) cirrosis.(8-10)
Sexo
Los hombres tienen un mayor riesgo de desarrollar CHC en comparación con las mujeres, con una proporción de hombres a mujeres que oscila entre 2:1 y 4:1 en la mayoría de las regiones. Esta disparidad se atribuye en parte a las tasas más altas de infecciones por el VHB y el VHC, el consumo de alcohol y el tabaquismo entre los hombres.(8-10)
Infección por los virus de las hepatitis B y C
Las infecciones crónicas por el VHB y el virus de la hepatitis C (VHC) son los factores de riesgo más críticos para el CHC. El VHB es la causa principal de CHC en áreas de alto riesgo, como China y África, mientras que el VHC es más prominente en países desarrollados, como los Estados Unidos. La presencia de cirrosis, los niveles séricos altos de ADN del VHB y el tiempo prolongado de seroconversión del HBeAg aumentan aún más el riesgo de CHC en los portadores crónicos del VHB. La coinfección con el VHB y el VHC o el VIH eleva significativamente el riesgo de CHC.(9-11-12)
Fisiopatología
Las lesiones hepáticas pueden ser benignas o malignas, y su fisiopatología varía de manera considerable entre estos dos tipos. Las lesiones hepáticas benignas incluyen adenomas hepatocelulares, hemangiomas y la hiperplasia nodular focal. Los adenomas hepatocelulares son tumores benignos que pueden transformarse malignamente, en especial aquellos con mutaciones en el gen CTNNB1 (catenina beta 1), o aquellos que muestran activación de vías inflamatorias o de Hedgehog.(13) Los hemangiomas y la hiperplasia nodular focal son por lo general fáciles de diagnosticar mediante imágenes y no suelen requerir tratamiento específico.(13) La clasificación molecular de los adenomas hepatocelulares en subgrupos específicos ha mejorado la capacidad de predecir su progresión y ha influido en la gestión clínica.(13)
Por otro lado, las lesiones hepáticas malignas, como el carcinoma hepatocelular (HCC) y el colangiocarcinoma (CCA), tienen una fisiopatología más compleja. El HCC generalmente se desarrolla en el contexto de cirrosis hepática y es el resultado de un proceso multietapa que incluye cambios patológicos, genéticos y epigenéticos que conducen a la iniciación, transformación maligna y progresión tumoral.(14) En algunos casos, el HCC puede surgir de la transformación maligna de un adenoma hepatocelular preexistente.(15) Las mutaciones en el promotor de TERT son alteraciones genómicas frecuentes en el proceso de carcinogénesis hepática.(15) El colangiocarcinoma se origina a partir de la transformación maligna de lesiones preneoplásicas como la neoplasia biliar intraepitelial (BilIN) y la neoplasia papilar intraductal del conducto biliar (IPNB).(14) Estas lesiones preneoplásicas experimentan alteraciones genéticas que conducen al desarrollo de adenocarcinomas tubulares o intestinales.(14)
Caracterización de lesiones hepáticas focales con TAC
La tomografía computada multidetector (TCMD) hace más eficiente el estudio del parénquima hepático poscontraste IV en cuatro fases de reforzamiento:
- Fase arterial hepática precoz: los primeros vasos hepáticos en reforzar son los arteriales de 15 a 25 segundos después de la inyección intravenosa del medio de contraste.
- Fase arterial hepática tardía o fase de flujo portal: la vena porta refuerza de los 35 a los 40 segundos.
- Fase parenquimatosa hepática o fase venosa hepática: las venas hepáticas suelen hacerlo entre los 60 y 70 segundos.
- Fase de equilibrio: entre los segundos 90 y 150 que se ha definido a través de curvas tiempo-densidad e indican el momento en que las pendientes de la curva aortica y parenquimatosa se tornan paralelas.
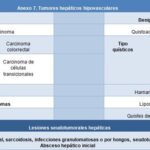
Las lesiones focales hepáticas (LFH) se han catalogado como hipervascular, hipovascular, benigna, maligna y seudotumoral (Anexos 6 y 7).
En la lesión hipervascular la irrigación depende exclusivamente de la arteria hepática, mientras que en la hipovascular la irrigación depende de la vena porta, y es por ello que la opacificación de las lesiones focales hepáticas (LFH) posterior al contraste es más lenta y se produce hacia la fase de equilibrio o tardía.(17)
En las lesiones hipervasculares que reportamos se incluye al CHC, al hemangioma y a la HNF que fueron mejor caracterizadas en la fase arterial del estudio dinámico por TCMD. se analizaron a las lesiones hepáticas por su forma de realce en la fase arterial y reportaron un valor predictivo positivo de 82% y una especificidad de 80% en los hemangiomas, metástasis y CHC. Otros datos asociados al CHC (Anexos 8 y 9-A)(20) fueron la hepatopatía previa, fístula arterioportal y trombosis de la vena, los cuales demuestran la asociación de los CHC con fístula arterioportal, y en el seguimiento de diferentes pacientes se encontró que no necesariamente la presencia de una fístula arterioportal se asocia con tumor maligno, ya que se ha encontrado asociaciones con hemangiomas. La mayoría de las lesiones hipovasculares que se encontraron corresponden a quistes hepáticos simples. Las lesiones seudotumorales fueron representadas por los abscesos hepáticos que fueron drenados y, en segundo lugar, la infiltración grasa.
El tipo de lavado de contraste que presentan las lesiones también importa, para lo cual utilizamos la fase de equilibrio, en la que el hígado sano ha lavado prácticamente todo el contraste, pudiendo observar lesiones hiperatenuantes si han retenido contraste, como el colangiocarcinoma (Anexo 9-B), o hipoatenuantes si han tenido un lavado rápido de contraste, como en el hepatocarcinoma.
Se realizó una caracterización por TCMD de la infiltración grasa que representa LFH mal delimitada, subsegmentaria, que no causa efecto de masa y no desplaza los vasos. El problema diagnóstico se presenta cuando existe infiltración grasa con “focos” de parénquima hepático sano, ya que esto puede simular una lesión tumoral o metastásica.(17-18)
Hepatocarcinoma (HCC)
El carcinoma hepatocelular es la sexta neoplasia más frecuente en el mundo y la tercera causa de muerte por cáncer. Se clasifica según el grado histológico, y de acuerdo con la Organización Mundial de la Salud existen cuatro grados:
- Bien diferenciado.
- Moderadamente diferenciado.
- Pobremente diferenciado.
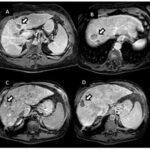
El principal factor de riesgo para su desarrollo es la cirrosis, principalmente la relacionada con la hepatitis viral crónica. Es este caso la hepatitis C, cirrosis alcohólica, cirrosis causada por hemocromatosis y cirrosis biliar primaria. La mayor parte de los casos en esta zona están relacionados con el virus de la hepatitis B, asociado o no con aflatoxina (micotoxinas producidas por dos especies de Aspergillus, un hongo localizado en especial en zonas con climas cálidos y húmedos). En el estudio de tomografía multicorte con técnica multifase el carcinoma hepatocelular (CHC) tiene vascularización predominantemente arterial, lo que determina un patrón de comportamiento específico caracterizado por un intenso reforzamiento en fase arterial, seguida de un lavado (washout) rápido en fase venosa portal, y en muchos casos la presencia de una seudocápsula en fases tardías. Este patrón ha resultado ser específico para el diagnóstico de carcinoma hepatocelular.(17-18)
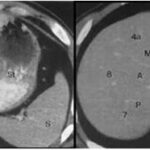
El CHC presenta una vascularización predominantemente arterial (por neovascularización) a medida que avanza el proceso de hepatocarcinogénesis, a diferencia del parénquima hepático, en donde la vascularización es mixta: arterial y portal. Este patrón característico, favorecido por la alta probabilidad del CHC en pacientes con hepatopatía crónica, ha mostrado una especificidad próxima al 100% para el diagnóstico de CHC. No obstante, este patrón vascular está penalizado por una sensibilidad del 60%-70% en lesiones de pequeño tamaño, y se ha descrito que alrededor de un 15% delos CHC de pequeño tamaño son hipovasculares al no haber desarrollado aún su neovascularización, sin que ello indique que estas lesiones tengan un comportamiento menos agresivo.(18-21) No obstante, en ocasiones el carcinoma hepatocelular puede ser hipovascular y no mostrar reforzamiento intenso en la fase arterial, siendo en estos casos muy importantes las fases venosas portal y venosa tardía, en donde la lesión permanece hipodensa o incluso puede presentar un comportamiento atípico con importante reforzamiento en la fase arterial y ausencia de lavado tardío (Anexos 10 y 11).
Las recomendaciones estándar para el diagnóstico de CHC incluyen TC multifásica o RMN, que son modalidades beneficiosas para resaltar características únicas de CHC (Anexos 12 y 13). Las diferencias fisiológicas en la perfusión sanguínea entre lesiones hepatocarcinogénicas y tejido no neoplásico muestran diferencias distintivas en las características de imagen utilizando exámenes de contraste multifásico.(23) Las fases consisten en arterial hepática tardía (20-40 s), venosa portal (60-90 s) y retardada (35 min). La fase arterial tardía es útil para detectar lesiones hipervasculares con lesiones de CHC que realzan característicamente en relación con el parénquima hepático circundante. El realce de la lesión arterial se puede apreciar dentro de lesiones tan pequeñas como 1 cm. Dentro de las fases venosa portal y retardada, se observa comúnmente lavado o hipointensidad para las lesiones de CHC. Durante la fase retardada o de equilibrio, se pueden visualizar otras características de CHC como características de la cápsula (p. ej., lavado de la lesión con realce de seudocápsula) y arquitectura en mosaico. La introducción de agentes de contraste basados en gadolinio (gadobenato de dimeglumina y ácido gadoxetato) puede ayudar a la categorización LI-RADS.(19) Estos agentes son absorbidos por los hepatocitos del parénquima hepático normal y hay poca absorción en hepatocitos no funcionales o disfuncionales, como el caso del CHC. Los agentes basados en gadolinio funcionan de manera similar a los agentes extracelulares, pero pueden ayudar en el diagnóstico de lesiones con características atípicas (p. ej., sin lavado, hiperrealce arterial) o distinguir el CHC de las seudolesiones. Por ejemplo, estos agentes permiten una fase hepatobiliar posterior al contraste adicional, que mostrará una mayoría de lesiones de CHC (90%-95%) como hipointensas en relación con el parénquima hepático hiperintenso circundante.(23)
Se recomienda la RMN para la estadificación de la enfermedad de CHC, dado que algunos informes han estimado que la TC subestima el 52% de los casos.(23) La RMN también tiene una eficiencia diagnóstica superior a la TC en la detección de lesiones pequeñas (≤ 3 cm). Sin embargo, la TC está más fácilmente disponible que la RMN, y las limitaciones para usar la RMN, incluidos mayores costos y complejidad técnica, hacen de la TC una alternativa diagnóstica complementaria. Un informe mostró que el uso combinado de TC/RMN proporciona una mejor precisión diagnóstica en la caracterización de lesiones hepáticas utilizando LI-RADS (91,29%) que la RMN (85,37%) o la TC (67,6%) solas, pero los protocolos combinados deben limitarse a casos difíciles o inciertos para justificar su uso.(21-23)
Elastografía
La elastografía es un método de imagen para cuantificar las propiedades mecánicas, en particular la rigidez, para evaluar los cambios cirróticos fibróticos focales (Anexo 14). Se puede cuantificar tanto la resonancia magnética como la ecografía, junto con un dispositivo que genera vibraciones de baja frecuencia (es decir, ondas transversales) y propagación de ondas, para calcular los niveles de rigidez en un área focal de interés. Introducidos por primera vez con la ecografía, existen múltiples métodos de elastografía que incluyen la elastografía transitoria, la onda transversal puntual, la onda transversal bidimensional y la elastografía cuasiestática. La elastografía por ecografía ha demostrado proporcionar una sensibilidad y especificidad satisfactorias para identificar los estadios histológicos de la fibrosis grave (sensibilidad: 81,9 %, especificidad: 84,7 %) y la cirrosis (sensibilidad: 84,8 %, especificidad 87,5 %). La elastografía por resonancia magnética también puede ayudar a diferenciar las lesiones hepáticas focales. Por ejemplo, se ha informado que los tumores malignos tienen mayores niveles de rigidez en relación con las lesiones benignas, las regiones fibróticas focales y el parénquima hepático normal.(23)
Espectroscopía de RM
La espectroscopía RM es una técnica analítica que permite la caracterización y cuantificación de la composición de metabolitos tisulares in vivo. Para cada vóxel dado, se representa un gráfico de la intensidad de la señal y los metabolitos/químicos se expresan por sus frecuencias. Se ha descubierto que las lesiones hepáticas malignas tienen niveles elevados de colina en relación con el parénquima hepático normal.
Existen cambios en las frecuencias de metabolitos entre hígados sanos y cirróticos, es decir, niveles de colina y lípidos. La colina es un componente de las membranas de fosfolípidos, que aumenta en estados de proliferación celular y carcinogénesis. Zhang et al. informaron que la eficacia diagnóstica de medir compuestos que contienen colina mediante espectroscopía RM es alta para discriminar tumores malignos y benignos (sensibilidad: 94,3% y especificidad: 93,3%). La determinación de proporciones de colina y lípidos dentro de una lesión dada también se ha utilizado para monitorear las respuestas al tratamiento después de la terapia locorregional. Por ejemplo, investigaciones prospectivas han descubierto que los niveles de colina disminuyen después de la terapia TACE.(23)
Para evaluar el pronóstico de CHC se ha de considerar no solo el estadio tumoral, sino también la función hepática y la presencia de síntomas relacionados con el tumor y asociación a otras patologías que incrementan la sintomatología.
El patrón de progresión en la terapia de primera línea con sorafenib en pacientes con carcinoma hepatocelular.(21) Los pacientes que desarrollan nuevas lesiones extrahepáticas tienen una menor supervivencia que aquellos con otros patrones. De acuerdo con el estadio basal y el patrón de progresión, se establecen diferentes grupos pronóstico, conocidos como clasificación BCLC (Barcelona-Clinic-LiverCancer) tras la progresión (BCLCp). BCLCp-B define la progresión radiológica debido al crecimiento de nódulos hepáticos existentes o nuevos focos intrahepáticos, pero el paciente se encuentra todavía dentro del estadio intermedio (BCLC B) a causa de la ausencia de invasión vascular o diseminación extrahepática. Los pacientes que presentan progresión radiológica y evolucionan a estadio avanzado (BCLC C) o progresan dentro de BCLC C se dividen en BCLCp-C1 (crecimiento de nódulos preexistentes o nuevos sitios intrahepáticos) y BCLCp-C2 (progresión por una nueva lesión extrahepática y/o invasión vascular).(23)
Hepatocarcinoma fibrolamelar
El carcinoma fibromelar hepatocelular es poco frecuente y representa menos de 1% de todos los casos. Se presenta principalmente en adolescentes y adultos jóvenes como una masa tumoral hepática única, con frecuencia de gran tamaño, sin asociación con cirrosis y rodeada de una cápsula fibrosa. En la tomografía multicorte, sin contraste, se observan tumores hipodensos heterogéneos con una cicatriz central muy hipodensa. También puede haber áreas de necrosis y calcificaciones. Son lesiones hipervasculares con captación intensa pero heterogénea (Anexo 15) del medio de contraste en fase arterial, la captación en fase portal y de equilibrio son variables y la cicatriz central, los septos y la cápsula del tumor son hiperdensos en fase tardía, incluyendo en los estudios de RM.(18-19)
Colangiocarcinoma
El colangiocarcinoma es una neoplasia maligna originada en el epitelio de las vías biliares. Representa el segundo tumor más frecuente del sistema hepatobiliar, por detrás del carcinoma hepatocelular. La mayoría son adenocarcinomas independientes de su localización en el hígado.
La International Classification of Diseases for Oncology (ICD-O) clasifica los colangiocarcinomas atendiendo a su localización anatómica y a su histología. De este modo, los colangiocarcinomas intrahepáticos con afectación de las vías biliares intrahepáticas se incluyen en los tumores primarios hepáticos y los colangiocarcinomas extrahepáticos con afectación del colédoco se agrupan con las neoplasias de vesícula. Casos especiales son los colangiocarcinomas hiliares o tumores de Klatskin a nivel de la bifurcación de los conductos hepáticos.
El Liver Cancer Study Group of Japan, en 2009, propuso una clasificación basada en el patrón de crecimiento tumoral, que es muy útil para el diagnóstico por imagen, ya que describe la apariencia macroscópica de la infiltración y de esta manera se complementa con los hallazgos encontrados en las pruebas de imágenes permitiendo realizar un diagnóstico diferencial. Clasifica los tumores en tres grupos: los formadores de masa, los de infiltración predominantemente periductal (Anexo 16) y los de crecimiento intraductal. Existe predominio de un patrón de crecimiento u otro en función de la localización topográfica: el colangiocarcinoma intrahepático suele debutar como una masa, mientras que en los colangiocarcinomas hiliar y extrahepático predomina la infiltración periductal.
El reforzamiento en anillo (hipercaptación periférica) o incluso menos de 25% de la lesión, y es más frecuente en nódulos mayores a 3 cm. En la fase venosa portal puede permanecer invariable cuando los nódulos son pequeños. Puede presentar un reforzamiento progresivo: existiendo el máximo realce en fases tardías (más frecuentes en nódulos de mayor tamaño). También puede demostrar un reforzamiento continuo con área central que no capta el medio de contraste. En la fase tardía la región central puede mostrar un reforzamiento variable en función de la existencia de fibrosis (aumento de la captación) o necrosis coagulativa (sin captación del contraste).(18-22)
Metástasis
Las metástasis son el tumor hepático maligno más frecuente y ocurren hasta 18 veces más que los tumores primarios. Como consecuencia de la circulación portal el hígado es el órgano en el que más frecuentemente se localizan metástasis. Entre el 60% y el 80% de los pacientes con antecedentes de carcinoma colorrectal, carcinoma de páncreas, cáncer de mama y otros tumores como los neuroendocrinos desarrollan metástasis hepáticas. La supervivencia de los pacientes con metástasis hepáticas depende de su extirpación quirúrgica.
La evidencia de las lesiones hepáticas obedece tanto al número y localización dentro del hígado, como a la presencia o no de enfermedad extrahepática. Esto último es importante en el proceso de selección de aquellos pacientes a los que se les debe o no ordenar una cirugía hepática. En la tomografía sin contraste las metástasis suelen ser iso o hipodensas respecto del resto de parénquima, salvo en casos de sangrado o calcificación intralesional en que pueden ser hiperdensas. Podemos observar calcificaciones en metástasis de tumores mucinosos del tracto gastrointestinal o en metástasis de ovario, mama, pulmón, riñón y tiroides.(18) Las metástasis suelen tener el mismo comportamiento que el tumor de origen, suelen ser hipovasculares en tumores de colon, pulmón, adenocarcinoma de páncreas y en tumores de vejiga y próstata. Se observan lesiones hipervasculares en tumores primarios de tiroides, tumores neuroendócrinos (carcinoide, tumor de islotes pancreáticos, feocromocitoma) y en melanoma, cáncer renal, coriocarcinoma y sarcomas.(18-19)
Dentro de los patrones de reforzamiento de las metástasis lo más frecuente que podemos encontrar en fase arterial es la captación periférica y continua (por efecto de parasitación de la lesión y reacción desmoplástica/inflamatoria del parénquima adyacente), metástasis homogéneamente hipercaptantes (suelen ser menores de 1,5 cm), metástasis heterogéneas por fibrosis y necrosis central (> 3 cm) o con mínima captación periférica (lesiones hipovasculares).(18) En las fases portal y venosa tardía el patrón más frecuente es la captación progresiva incompleta. En menor grado se observan lesiones que se hacen isodensas con el resto de parénquima o persistencia de una mínima captación periférica (Anexo 17). El fenómeno de lavado (washout) periférico se ha descrito como hallazgo típico de metástasis, consiste en la desaparición del contraste en la periferia de la lesión en fases retardadas, es más frecuente en las metástasis hipervasculares, especialmente en tumores neuroendocrinos. Supone una mejor vascularización arterial y venosa en la periferia, donde se sitúa el tumor viable, respecto al centro de fibrosis o necrosis.(18-22)
Lesiones benignas
Generalmente son halladas en pacientes asintomáticos y/o sin antecedentes de enfermedades hepáticas, constituyéndose como hallazgo incidental (incidentalomas). La evidencia de estas lesiones varía entre 12% y 52% en distintas series, según la población estudiada y el método de diagnóstico utilizado. En la mayor parte de los casos tienen una apariencia típica y es fácil diferenciarlas de lesiones malignas, pero pueden presentarse de forma atípica y plantear un serio problema para el diagnóstico. La principal diferencia con las lesiones malignas es el patrón de reforzamiento (ausencia de lavado). Dentro de los más frecuentes tenemos a los que se describen a continuación.(17-18)
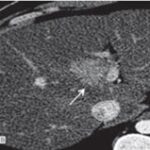
Es el tumor hepático benigno más frecuente. Histológicamente consiste en espacios vasculares delimitados por endotelio y separados por septos fibrosos. Contienen gran cantidad de sangre con un flujo muy lento. Pueden ser únicos (más frecuentes) o múltiples. Se observan como lesiones hipodensas, bien delimitadas en el estudio sin contraste. Tras la administración del medio de contraste pueden presentar tres tipos de reforzamiento dependiendo de su tamaño:
- Nodular, empezando desde la periferia de forma centrípeta; en fase tardía se verá como una lesión hiperdensa (lesiones medianas) (Anexo 18).
- Homogéneo inmediato en fase arterial (lesiones menores de 1 cm).
- Periférico centrípeto con persistencia de la zona central e hipodensa en fase tardía que corresponde a cicatriz o áreas de trombosis (lesiones de gran tamaño) (Anexo 19).(17-18)
Síndrome de Kasabach-Merritt en pacientes en edad pediátrica
El desarrollo de síndrome de Kasabach-Merritt, definido como la aparición de coagulopatía por consumo asociada a la presencia de una lesión vascular, es una complicación descrita. Los hemangiomas focales suelen involucionar hacia los 18 meses de edad. Las lesiones multifocales se asocian con más frecuencia a hemangiomas múltiples en la piel,(25) por lo tanto, se diagnostican, en muchas oportunidades, en estudios realizados por pesquisa o screening (se realiza el estudio ecográfico abdominal ante la presencia de cinco o más lesiones en la piel). Suelen tener un comportamiento clínico más benigno (Anexo 20).
Por último, las lesiones difusas son clínicamente más agresivas. Generan un síndrome compartimental que puede evolucionar con falla multiorgánica y presentan mayor mortalidad. Históricamente, el tratamiento de primera línea fueron los corticoides. También se han indicado interferón, vincristina, con resultados variables y alta frecuencia de efectos adversos. Además, se han utilizado la embolización por técnicas de intervencionismo y procedimientos quirúrgicos, incluido el trasplante hepático. En 2008, se describió por primera vez el uso de propanolol,(25) un betabloqueante no selectivo, como tratamiento de los hemangiomas.(17-25)
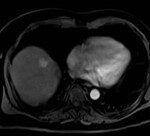
La hiperplasia nodular focal es el segundo tumor benigno más frecuente después del hemangioma. Tiene mayor incidencia en mujeres jóvenes. Histológicamente es un tumor hiperplásico que conserva los mismos componentes del tejido hepático normal, pero con una arquitectura alterada (hepatocitos normales + células de Kupffer + conductos biliares primitivos no conectados con la vía biliar normal). Presentan una cicatriz central de tejido fibroso con estructuras vasculares dilatadas y ectásicas. En la tomografía multicorte sin contraste intravenoso se evidencia como una lesión homogénea bien definida, hipo o isodensa con respecto al parénquima hepático. En la tomografía multicorte multifásica, después de la administración del medio de contraste, tiene un comportamiento típico.
- Fase arterial: reforzamiento intenso.
- Fase portal: es isodenso o ligeramente hiperdenso con respecto al parénquima.
- Fase tardía: lesión totalmente isodensa, no se visualiza, excepto porque puede producir efecto de masa sobre el parénquima adyacente.
La cicatriz central (Anexos 21 y 22), al estar menos vascularizada, no refuerza en fase arterial. Sin embargo, en fase tardía muestra hiperdensidad cuando ya el resto de la lesión se ha hecho isodensa.(18)
Son tumores poco frecuentes. Histológicamente están formados por hepatocitos bien diferenciados sin conductos biliares ni triada portal (tumor formado exclusivamente por hepatocitos). Pueden presentar áreas intralesionales de necrosis y de hemorragia. Es más frecuente en las mujeres (90%) que toman anticonceptivos orales y en hombres que toman esteroides anabólicos, así como en pacientes con enfermedades por depósito (glucogenosis tipo 1 o diabetes).
El aspecto de los adenomas en RM es variable ya que sus características pueden cambiar dependiendo de su contenido de grasa, presencia de hemorragia o fibrosis. Sin embargo, en general se presentan como masas hipointensas en T1, pero pueden tener áreas hiperintensas por presencia de sangre o de grasa.
En T2 son por lo general hiperintensos. Después de la inyección de contraste(18-24) paramagnético se observa un aumento de señal homogénea y muy precoz. La heterogeneidad de la señal es producto del amplio rango de cambios patológicos en el tumor, y es considerada una de las características más constantes del comportamiento del adenoma en RM. La mayor parte de los adenomas son solitarios (80%); entre 1% y 5% puede evolucionar a carcinoma hepatocelular.
Actualmente los adenomas se clasifican en tres subgrupos, dependiendo de su genotipo.(18) Es importante la clasificación para poder establecer su comportamiento, hallazgos por imagen, historia natural y, sobre todo, un riesgo variable de presentar complicaciones como hemorragia o malignización. Por ende, según sea el subtipo, también difiere el tratamiento. En la tomografía multicorte, en fase sin contraste, se observan como lesiones bien definidas, isodensas o ligeramente hipo o hiperdensas con respecto al parénquima (Anexo 23). Pueden presentar una densidad heterogénea o áreas de hemorragia.
En las fases dinámicas, tras la administración de medio de contraste,(18-24) son lesiones hipervasculares, ya que muestran importante reforzamiento en fase arterial. En las fases venosas portal y tardía se pueden diferenciar según el subtipo como: adenoma inflamatorio: persistencia del reforzamiento; adenoma HNF1A mutado: que se observa isodenso con respecto al parénquima normal; beta catenina mutada: que es hipervascular en fase arterial con lavado del medio de contraste similar al carcinoma hepatocelular.(18-20-24)
Son lesiones muy frecuentes, con una incidencia estimada en el adulto de 2,5% de la población general. Esta incidencia aumenta con la edad, siendo raras en niños.
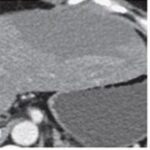
Los quistes hepáticos (Anexo 24) simples están formados por epitelio biliar y no comunican con la vía biliar. Las últimas teorías sugieren un origen hamartomatoso. Los quistes hepáticos pueden ser únicos o múltiples y pueden presentarse en el contexto de una enfermedad poliquística. En tomografía multicorte sin contraste se observan como lesiones hipodensas, con respecto al parénquima hepático, y se comportan como lesiones avasculares tras la administración de medio de contraste.
Según los últimos compendios se sigue considerando lesión quística, aunque esté presente hasta el 25% de contenido sólido.(18-20)
LI-RADS
Conocido como “Sistema de datos e informes de imágenes hepáticas” (LI-RADS) es un sistema integral que utiliza terminología estandarizada, técnica, interpretación y reporte de imágenes hepáticas. Eso ha sido desarrollado por un equipo multidisciplinario de diagnóstico y radiólogos intervencionistas, cirujanos hepatobiliares, hepatólogos y hepatopatólogos con el apoyo de American College of Radiology (ACR) en 2011. Se desarrollaron algoritmos para la categorización de observaciones de imágenes no tratadas en pacientes con riesgo de desarrollo de carcinoma hepatocelular (CHC). Este ha sufrido cuatro actualizaciones importantes en 2013, 2014, 2017 y en 2018.(26-27-28)
El CEUS LI-RADS (Contrast Enhanced Ultrasound) se desarrolló en 2016 y se actualizó una vez en 2017.(19-26-27-28) El ACR propuso en el año 2011 el sistema LIRADS (Liver Imaging Reporting and Data System) para la lectura de las imágenes de TC y RM, con la finalidad de estandarizar la interpretación de los informes de TC y RM hepática en pacientes con hepatopatía crónica, y seguidamente establecer una recomendación clínica según el grado de sospecha de que la lesión detectada correspondiera a un CHC. La ACR ha ido actualizando el sistema LI-RADS y en su última versión clasifica las observaciones en seis grandes categorías:
- LR-1 (definitivamente benigno).
- LR-2 (probablemente benigno).
- LR-3 (probabilidad intermedia para CHC).
- LR-4 (probablemente CHC).
- LR-5 (definitivamente CHC).
- LR-M (other malignancies: lesiones con alta probabilidad de ser neoplasias malignas diferentes de CHC).(19-21-26-27-28)
El cambio más importante introducido en v2018 afecta la categorización de 10 a 19 mm, observaciones con APHE sin borde y “lavado” no periférico. En v2017 y versiones precedentes, anteriormente la visualización en ultrasonido fue requerida para considerarlo dentro de la categoría de LR-5. En v2018, el requisito para la visibilidad de ultrasonido se eliminó, de modo que todas las lesiones de 10 a 19 mm observadas con APHE, sin borde y sin “lavado” no periférico se clasifican en LR-5.(19-26-27)
En LI-RADS v2018, la definición de crecimiento umbral se simplificó para incluir solo el aumento de tamaño de una masa en ≥50% en ≤6 meses. Las otras dos definiciones de umbral de crecimiento utilizado en las versiones anteriores (una nueva observación ≥10 mm en ≤24 meses y aumento de tamaño de una masa en ≥100% en >6 meses) ahora se consideran subumbrales de crecimiento. El cambio a los criterios de umbral de crecimiento rebaja un subconjunto de observaciones que habrían sido categorizado como LR-5 en versiones anteriores a LR-4 en v2018. Sin embargo, esto afecta <1% de todos los LR-3 y LR-4 y solo el 2% de LR-5 observaciones.(19-26-27-28)
Algoritmo diagnóstico en TC y RMI
El algoritmo de diagnóstico CT/MRI asigna una categoría para cada observación en función de su probabilidad de benignidad, malignidad o CHC. Las categorías van desde LR-1 (definitivamente benigno) hasta LR-5 (definitivamente HCC). El LR-5 categoría tiene una especificidad de aproximadamente el 95% para el diagnóstico de HCC. Tres categorías adicionales incluyen LR-NC (no categorizable), LR-TIV (tumor definitivo en una vena) y LR-M (probable o definitivamente maligno, no específico de CHC). Asignación de categoría en LI-RADS se basa en varias combinaciones de cinco características principales de imagen y un número de funciones auxiliares (AF). Las características principales incluyen hiperrealce sin borde en fase arterial (APHE), sin lavado periférico, mejora de “cápsula”, tamaño y umbral crecimiento.(19-26-27-28)
Diagnósticos diferenciales
Conforme al Manual de Medicina Interna Basada en la Evidencia 2021/2024, el diagnóstico diferencial para esta patología se basa en la detección de lesiones focales en el hígado, dentro de las que podemos encontrar: adenoma hepático, tumores metastásicos, carcinoma de las vías biliares intrahepáticas, hiperplasia nodular focal.
En la población pediátrica el diagnóstico diferencial que destaca es el hepatoblastoma, considerado como el principal tumor hepático de este grupo etario en países occidentales. No obstante, al igual que en la población adulta, la diferenciación diagnóstica también podría consistir en la determinación de hiperplasia nodular focal (HNF), el adenoma hepático y otras neoplasias hepáticas malignas menos comunes, el linfoma que se presenta como en la inmensa mayoría de casos de lesiones secundarias que en la tomografía multicorte se comportan como lesiones hipovasculares homogéneas. Aunque la presentación como lesión única es la menos habitual es la que ofrecerá más problemas en el diagnóstico diferencial respecto de lesiones sólidas, y se agrega el sarcoma embrionario indiferenciado. (Orphanet, 2024).(21-22)
Métodos diagnósticos
La mayoría de los tumores hepáticos se diagnostican mediante TC realizada por diversas sintomatologías y/o sospechas de alguna patología, seguida de resonancia magnética. Las pruebas de imagen pueden emplearse para clasificar según su contenido y dinámica mediante el empleo de contraste endovenoso.(20)
Protocolo de estudio de las lesiones hepáticas
Tenemos cuatro fases y se puede agregar una quinta en caso de que exista sospecha por parte de tumores hipervascularizados:
- Estudio basal sin contraste.
- Fase arterial (temprana y tardía). Se obtiene normalmente a los 25-35 seg. de la administración de contraste, aunque en fase más temprana puede obtenerse a los 15 seg. de iniciada la administración de contraste EV.
- Fase portal. A los 65-70 seg.
- Fase tardía. A partir de 180-300 seg. La más fundamental, donde categorizamos la mayoría de estos tumores hepáticos.(17-18)
Medios de contraste
En nuestro servicio los que más utilizamos para tomografía son el DOTAREM o ULTRAVIST (Gadoterato de meglumina), el TEMISTAC (Diatrizoato de meglumina y sodio) y BARIO como medios de contraste oral positivo.
Agentes hepatoespecíficos en RM. Para la realización de la resonancia magnética (RM) hepatobiliar se utilizan dos tipos de medios de contraste, los extracelulares y los intracelulares. El primer grupo son los medios de contraste derivados del gadolinio, que tienen un comportamiento intravascular y extracelular.(1-5)
El segundo grupo, conocido también como órganos específicos, tiene un comportamiento intravascular, extracelular e intracelular. En la actualidad, dos de estos agentes están disponibles comercialmente: Gadobenato de dimeglumina (GdBOPTA) y ácido gadoxético (Gd-EOB-DTPA). El ácido gadoxético es de gran utilidad en la detección y caracterización de lesiones focales hepáticas y en la valoración de la vía biliar, suministrando información adicional a las secuencias convencionales. Debido a su estructura molecular, que contiene una parte hidrosoluble y otra lipofílica (EOB-etoxibencil), muestra un mecanismo de acción bifásico. Inicialmente presenta una distribución en el espacio extracelular que permite la adquisición de imágenes dinámicas (arterial, portal y transicional). También presenta una distribución intracelular con captación selectiva por los hepatocitos y excreción hacia la vía biliar. Esta fase es conocida como hepatobiliar, y se obtiene aproximadamente a los 20 minutos luego de la inyección del medio de contraste.
El uso de ácido gadoxético en los estudios de RM está aceptado en la reciente actualización de las guías para el manejo del CHC de la EASL y de la AASLD. En ambas sociedades científicas se considera como criterio diagnóstico no invasivo de CHC un patrón vascular definido como captación arterial y lavado en la fase portal, mientras que las características de la lesión en las fases transicional y hepatobiliar no son tenidas en cuenta, ya que son fases mixtas o exclusivamente hepatobiliares en las que la hiposeñal de la lesión no es consecuencia de la disminución o ausencia de vasos portales en el CHC, sino de la disminución o ausencia de la expresión de OATP, que es un transportador responsable de la captación celular del contraste, y que está en general ausente en el CHC.
Por otra parte, se han descrito artefactos respiratorios transitorios durante la fase arterial del ácido gadoxético en un porcentaje de estudios que oscila entre el 2,4% y el 18%, que se atribuyen a una dificultad de los pacientes para mantener la apnea durante los primeros segundos tras la inyección del contraste.
Finalmente, la secuencia en fase hepatobiliar suele ser deficiente en pacientes con insuficiencia hepática importante. La disfunción hepática y la obstrucción biliar pueden alterar la farmacocinética del contraste, retardando y disminuyendo la captación del medio de contraste por el hepatocito, lo que a su vez disminuye la intensidad de la señal hepática y su excreción en la fase hepatobiliar.
Con respecto a la farmacocinética del ácido gadoxético, este compuesto tiene una vida media de una hora y es eliminado en similares proporciones por vía biliar en un 43%-53% y renal en un 41%-51%.(24)
Hallazgos por imágenes
En la fase hepatocelular, el parénquima hepático aparece homogéneamente hiperintenso desde los 20 minutos hasta los 120 minutos luego de la administración del agente en las secuencias ponderadas en T1 a dosis de 0,025-0,050 mmol/kg. Adicionalmente, el contraste se hace visible en los conductos biliares (Anexo 25) y las estructuras vasculares aparecen hipointensas respecto al parénquima hepático. La captación intralesional del ácido gadoxético en la fase hepatobiliar indica que la lesión contiene hepatocitos con las proteínas transportadoras específicas, como sería el caso de los nódulos regenerativos y la hiperplasia nodular focal (HNF).(20)
Las lesiones que no tienen hepatocitos funcionales o que son carentes de conductos biliares aparecen hipointensas respecto del parénquima hepático en esta fase, lo que ocurre en el caso de los adenomas hepatocelulares (AHC), los nódulos displásicos de alto grado, el carcinoma hepatocelular (CHC) y metástasis, entre otras.(20)
Las estructuras vasculares y los hemangiomas son de baja señal en la fase hepatobiliar, excepto cuando existe alteración de la función hepática por colestasis o daño hepatocelular. En esas circunstancias, el realce del parénquima puede ser débil, haciendo que las estructuras vasculares y los hemangiomas se observen isointensos en la fase hepatobiliar. Es así como, al usar medios de contraste órgano específicos, hay una mayor detección de las diferentes lesiones focales hepáticas, ya que se comportan de acuerdo con su histología y se aumenta de 80% a 87% el rendimiento diagnóstico de la RM.(20)
Sobrevida
La supervivencia promedio en pacientes con carcinoma hepatocelular (CHC) está influenciada por los factores de riesgo individuales, las características del tumor, su estadio y la funcionalidad hepática, es decir, si esta se encuentra conservada o si existe insuficiencia hepática clínica. Ante un diagnóstico temprano y un tratamiento inicial adecuado representaría el escenario óptimo, ya que mostraría un pronóstico favorable. Sin embargo, la mayoría de los pacientes, al momento del diagnóstico, presentan la enfermedad en una fase avanzada, lo que disminuye de manera considerable las tasas de supervivencia a largo plazo.(16)
Respecto de las opciones terapéuticas, las dos intervenciones quirúrgicas principales (la resección hepática y el trasplante de hígado) han demostrado hasta la fecha ser las mejores alternativas en casi todos los estadios, logrando una supervivencia media de hasta 44,7 meses, en comparación con la quimio embolización transarterial, que ofrece una supervivencia media de solo 23,7 meses. Se han identificado factores de mal pronóstico que elevan el riesgo de mortalidad en estas poblaciones, afectando directamente la supervivencia, tanto a corto como a largo plazo.(16) Edad ≥ 60 años factores a tener en cuenta:
- Tamaño del tumor ≥ 10 cm.
- Cantidad de nódulos o tumores ≥ 3.
- Concentraciones séricas de alfa-fetoproteína ≥ 400 ng/ml.
- Concentraciones séricas de alanina aminotransferasa ≥ 80 U/l.
- Bilirrubina sérica total ≥ 1,2 mg/dl.
Enfoque metodológico
Este estudio adoptó un diseño longitudinal, descriptivo y observacional del cual hicieron parte un total de 550 pacientes. De esto, el 70% (385) eran de sexo masculino y el 30% (165) eran de sexo femenino, con edades a partir de los 18 años. Cada uno de ellos concurrió al Hospital General de Agudos José María Ramos Mejía entre febrero de 2022 y agosto de 2024 para realizarse estudios diagnósticos de tomografía computarizada. Para estos se utilizaron proyecciones axiales, longitudinales y coronales.
Para realizar las tomografías computarizadas se utilizó el tomógrafo CANON (Aquilion) Lightning (Anexo 26), que genera 16 cortes por rotación. Se evidenciaron lesiones hepáticas benignas (quistes hepáticos en el 52%, seguidos de hemangiomas con el 19%, hiperplasia nodular focal con el 12%, y por último, adenoma hepático con el 9%) y lesiones malignas (hepatocarcinoma con el 16%, colangiocarcinoma con el 2%, seguido de hepatocarcinoma fibromelar con el 2%, y metástasis con el 1%), las cuales se localizaron por medio del tomógrafo. Se trazaron coordenadas a referencias externas para proceder a realizar biopsia, por la que se obtuvo la confirmación de la clasificación de la lesión, previa organización de mesa con los materiales estériles (Anexo 27), y se realizó antisepsia y anestesia local, se introdujo aguja espinal, Trucut o Menghini, obteniéndose material para su estudio por anatomía patológica. En imágenes de control no se visualizan lesiones inmediatas del procedimiento. La muestra fue enviada a patología en el laboratorio del hospital. Previo a la toma de la biopsia se solicitó laboratorio, que incluyó hemograma y coagulograma completo. Todo esto con previa autorización, verificación de la información, explicación del procedimiento por parte del médico radiólogo y la firma del consentimiento informado (Anexo 28).
Recopilación de datos
La recopilación de datos de los pacientes que forman parte del estudio se realizó mediante el análisis de los informes a través de la base datos SINAPSIS, la misma que almacena la información entre los años 2022 y 2024, en pacientes que se realizaron tomografía en el Hospital General de Agudos José María Ramos Mejía, y resonancia magnética, procedentes de centros periféricos en los cuales en la mayoría se sospechaba o estaba confirmada una lesión hepática o de la vía biliar, y en otros se presentaron como hallazgos incidentales.
Criterios de inclusión
- Pacientes a partir de los 18 años, de ambos sexos, a quienes se les realizó tomografía computada de abdomen y pelvis.
- Pacientes que presentaron resonancia magnética de abdomen y pelvis realizadas en centros periféricos.
- Pacientes ambulatorios e internados provenientes de otra institución.
- Pacientes con diagnóstico confirmado por lesiones hepáticas o sospecha de estas.
Criterios de exclusión
- Pacientes menores de 18 años.
- Pacientes con estudios incompletos o que no se realizaron laboratorio.
- Pacientes con antecedentes de intervenciones hepáticas.
- Pacientes a los que no se les realizó tomografía computada de abdomen y pelvis en el Hospital General de Agudos José María Ramos Mejía.
Interpretación y análisis de resultados
- Mediante análisis observacional y descriptivo.
- Utilización del sistema de archivo y transmisión de imágenes.
- Lectura, interpretación y reporte de imágenes a cargo de médicos especialistas en Diagnóstico por Imágenes a través del sistema LI-RADS v2018.
La fiabilidad de los datos se puede garantizar mediante:
- La utilización de equipos y procedimientos estándar para las tomografías computarizadas.
- Consistencia en la interpretación de resultados por parte de médicos especialistas en seguir el sistema LI-RADS.
- Obtención de información por parte del laboratorio de planta que nos proporciona los datos histológicos e inmunohistoquímica utilizando marcadores específicos, y el Servicio de Anatomía Patológica.
Resultados
Este estudio nos permitió revelar sobre la base de una muestra de 550 pacientes que se sometieron a tomografía en el Hospital General de Agudos José María Ramos Mejía, las incidencias de las lesiones focales hepáticas, características y clasificar los hallazgos más comunes descritos a continuación:
Concurrencia de pacientes atendidos en el hospital
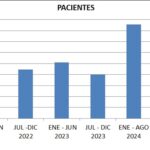
El siguiente gráfico describe la concurrencia de pacientes estudiados desde febrero de 2022 hasta agosto de 2024, detallado por semestres.
Gráfico 1
Distribución etaria
El siguiente grafico nos permite analizar en qué grupo etario se presentaron con mayor frecuencia las lesiones hepáticas halladas en la población estudiada, siendo de mayor relevancia en nuestra muestra pacientes entre la quinta y la sexta década de la vida. El 70% se evidenciaron en pacientes de sexo masculino (correspondiente a 385 pacientes) y el 30% en pacientes de sexo femenino (correspondiente a 165), pero pudimos observar que se pueden presentar a cualquier edad, teniendo en cuenta los factores de riesgo asociados.
Gráfico 2
Resultado de lesiones hepáticas encontradas
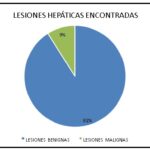
El siguiente gráfico nos permite analizar la incidencia de lesiones hepáticas detectadas en los pacientes estudiados en el Hospital General de Agudos José María Ramos Mejía, donde podemos observar que la mayoría de las lesiones encontradas son de tipo benignas, con un 91% del total de la muestra, correspondiente a 502 pacientes (345 de sexo masculino y 157 de sexo femenino), seguidas de un 9% de pacientes que presentaron lesiones malignas, correspondiente a 48 pacientes (40 de sexo masculino y 8 de sexo femenino).
Gráfico 3
Descripción de lesiones benignas encontradas
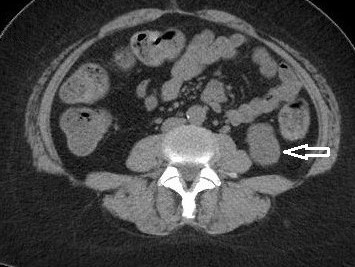
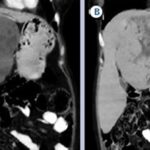
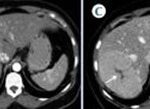
Como podemos observar, dentro de las lesiones benignas se encuentran con una gran incidencia los quistes hepáticos (Anexo 29), que representan el 52% del total de la muestra de la población (un total de 280 pacientes, de los cuales 207 son de sexo masculino y 73 de sexo femenino). Luego les siguen los hemangiomas (Anexo 30), que representan el 19% del total de la muestra (correspondiente a 110 pacientes, 81 de sexo masculino y 29 de sexo femenino). Encontramos una incidencia representada con un 12% (perteneciente a 64 pacientes, 44 de sexo masculino y 20 de sexo femenino), que presenta hiperplasia nodular focal (Anexo 31). Y un 9% (correspondiente a 48 pacientes, 35 de sexo femenino y 13 de sexo masculino) de la población estudiada presentó adenomas hepáticos; la mayoría de estas pacientes tenían antecedentes de uso de anticonceptivos, que tomaban desde hacía más de cinco años (Anexo 32). Con respecto a estos últimos, se evidenció que el 1% de los pacientes que presentaron esta lesión evolucionaron a un carcinoma hepatocelular (Anexo 33), resuelto debido a su diagnóstico temprano.
Gráfico 4
Descripción de lesiones malignas encontradas
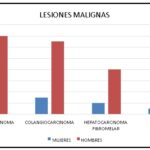
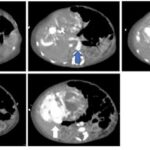
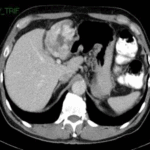
Dentro de las lesiones malignas que se describen en el siguiente gráfico, los hepatocarcinomas (Anexo 34) son los que encabezan la lista de las más halladas, representando el 3% (correspondiente a 16 pacientes, 14 de sexo masculino y 2 de sexo femenino). Les siguen los colangiocarcinomas (Anexo 35), que equivalen al 3% de la muestra (13 pacientes, 10 de sexo masculino y 3 de sexo femenino), siendo esta lesión encontrada en pacientes con decendencia asiática mayoritariamente. Continúan los hepatocarcinomas fibromelar, con el 2% (10 pacientes, 8 de sexo masculino y 2 de sexo femenino), evidenciados más en pacientes jóvenes entre los 18 y 30 años (Anexo 36), y metástasis (Anexo 37), representan un bajo porcentaje dentro de la población estudiada, siendo estos últimos eel 1% de la población (6 pacientes, 5 de sexo masculino y 1 de sexo femenino); dicha metástasis en la paciente fue hipervascular, desencadenada a raíz de un tumor pancreático (Anexo 38).
Gráfico 5
Discusión
La investigación retrospectiva y de tipo vertical realizada en el Hospital General de Agudos José María Ramos Mejía, abarcando 550 pacientes que se sometieron a tomografía computada multicorte (TC), ha permitido caracterizar de forma detallada las lesiones hepáticas encontradas en la muestra poblacional, cumpliendo con el objetivo de determinar tanto la prevalencia como la incidencia de estos hallazgos en la población estudiada.
Los resultados obtenidos muestran una prevalencia considerable de lesiones benignas, representando el 91% de los casos, mientras que las lesiones malignas abarcan el 9%. Este hallazgo es consistente con estudios previos que sugieren una mayor frecuencia de lesiones benignas en la población general, en especial en pacientes de mediana edad, lo que concuerda con el predominio en nuestro estudio de lesiones en la quinta y sexta década de la vida.
La observación de una mayor incidencia en mujeres con lesiones benignas, como adenomas hepáticos, también es coherente con factores de riesgo específicos, tales como el uso de anticonceptivos orales y otras condiciones hormonales, que han sido ampliamente estudiados como factores predisponentes de lesiones hepáticas benignas.
En cuanto a las lesiones malignas, los hepatocarcinomas constituyen el tipo más frecuente (3%), en conjunto con los colangiocarcinomas (3%) y otras manifestaciones menos comunes, como los hepatocarcinomas fibrolamelares y metástasis hepáticas de origen pancreático en el caso de los pacientes presentados en nuestro estudio. Estos hallazgos concuerdan con la literatura, que resalta el predominio de hepatocarcinomas en pacientes con antecedentes de cirrosis, hepatitis viral o consumo excesivo de alcohol. Sin embargo, la baja incidencia de metástasis hepáticas puede deberse a la selección de pacientes y las características de la muestra.
Conclusión
Este estudio logró con éxito los objetivos propuestos de describir y clasificar las lesiones hepáticas observadas mediante tomografía computada en la población estudiada en el Hospital General de Agudos José María Ramos Mejía, permitiendo establecer una prevalencia e incidencia detalladas. Los datos obtenidos refuerzan la literatura actual al mostrar una mayor prevalencia de lesiones benignas en comparación con las malignas, con un predominio en pacientes de mediana edad y un ligero aumento en la incidencia en mujeres predominado estas lesiones en hombres. Además, los resultados sugieren la importancia de la vigilancia médica, en especial en casos de adenomas, donde el diagnóstico temprano permitió intervenir antes de la progresión a carcinoma.
Estos hallazgos brindan información valiosa para guiar el diagnóstico y tratamiento en pacientes con riesgo de lesiones hepáticas y resaltan la necesidad de establecer protocolos cada vez más actualizados, como en el caso de LI-RADS v18 para el seguimiento, clasificación y monitoreo de lesiones hepáticas que mejoren los resultados a largo plazo. También en destacar el papel indispensable de el médico radiólogo en la implementación e interpretación de estudios imagenológicos para poder obtener un diagnóstico certero e iniciar un tratamiento lo más rápido posible para mejor la calidad de vida del paciente. En futuros estudios, sería beneficioso ampliar la muestra y considerar otras variables, como antecedentes clínicos y factores de riesgo individuales por paciente muestreado, para afinar el análisis y mejorar las estrategias de prevención y tratamiento de lesiones hepáticas en nuestra población.
Recomendaciones
- La tomografía computada multidetector (TCMD) y la resonancia magnética (RMI) deben continuar siendo las herramientas de primera línea en la caracterización de lesiones hepáticas. La implementación de protocolos de cuatro fases en TCMD y el uso de agentes de contraste hepatobiliares en RMI permiten una evaluación precisa, facilitando la diferenciación entre lesiones benignas y malignas. La precisión diagnóstica es esencial para evitar estudios invasivos innecesarios y guiar de forma adecuada el manejo clínico.
- El uso del sistema LI-RADS y su última versión es crucial en pacientes con hepatopatía crónica y riesgo de carcinoma hepatocelular (CHC). Se recomienda que los especialistas se familiaricen con sus actualizaciones para optimizar la interpretación y el manejo de los casos.
- Dado que el hepatocarcinoma se relaciona estrechamente con factores de riesgo como la cirrosis hepática, hepatitis crónica y síndrome metabólico, se recomienda el monitoreo continuo en pacientes con estas condiciones. Las evaluaciones de rutina mediante pruebas de imagen y niveles de alfafetoproteína (AFP) pueden facilitar la detección temprana de CHC, optimizando el pronóstico y reduciendo la mortalidad asociada.
- La alta incidencia de quistes hepáticos y hemangiomas sugiere la necesidad de una evaluación minuciosa para distinguir incidentalomas benignos de lesiones malignas, por lo que se debe trabajar de manera multidisciplinaria con otras especialidades.
- Se recomienda que estos informes sigan un formato estandarizado y completo, siendo ordenados, claros y concisos. La precisión en los reportes facilita una toma de decisiones adecuada y es esencial para el seguimiento y la calidad de vida del paciente.
- Se recomienda la formación continua en los avances de la imagenología hepática, incluyendo el uso de técnicas de imagen avanzada y nuevos protocolos diagnósticos.
- En los casos de lesiones hepáticas malignas, especialmente CHC, es recomendable un enfoque multidisciplinario que integre a hepatólogos, radiólogos, oncólogos y cirujanos.
Anexos






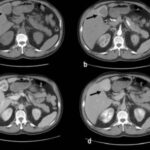



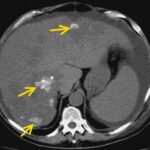
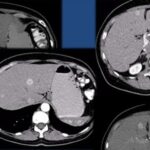
Referencias bibliográficas
- Manterola, C., Del Sol, M., Ottone, N. y Otzen, T. (2017). Anatomía Quirúrgica y Radiológica del Hígado. Fundamentos para las Resecciones Hepáticas. Int J Morphol, 35 (4), 1525-1539. https://www.scielo.cl/scielo.php?script=sci_arttext&pid=S071795022017000 401525
- Kaltenbach, T. E. M., Engler, P., Kratzer, W., Oeztuerk, S., Seufferlein, T., Haenle, M. Graeter, T. (2016). Prevalencia de lesiones hepáticas focales benignas: estudio ecográfico de 45.319 pacientes hospitalizados. Abdom Radiol, (41), 25-32. https://pmc.ncbi.nlm.nih.gov/articles/PMC4735268/
- Maillette de Buy Wenniger, L., Terpstra, V., Beuers, U. (2010). Hiperplasia nodular focal y adenoma hepático: epidemiología y patología. Dig Surg, 27 (1), 24-31. https://karger.com/dsu/article/27/1/24/116236/Focal–Nodular–Hyperplasiaand–Hepatic–Adenoma
- Gordan, J. D. et al. (2024). Terapia sistémica para el carcinoma hepatocelular avanzado: actualización de las directrices de la ASCO. Open Evidence, 42(15), 1830-1850. https://www.openevidence.com/ask/74e286ed–b311–4bfc–bc3d–e7fc24f665d4
- Debes, J. D. et al. (2018). Carcinoma hepatocelular en América del Sur: evaluación de factores de riesgo, demografía y tratamiento. Liver Internacional, 38(1), 136-143. https://onlinelibrary.wiley.com/doi/10.1111/liv.13502
- Rumgay, H., Ferlay, J., de Martel, C. et al. (2022). Carga mundial, regional y nacional de cáncer primario de hígado por subtipo. EJC, 161, 108-118. https://www.ejcancer.com/article/S0959–8049(21)01243–0/abstract
- Chuang, S. C., La Vecchia, C., Boffetta, P. (2009). Cáncer de hígado: epidemiología descriptiva y factores de riesgo distintos de la infección por VHB y VHC. Cancer letters, 286(1), 9-14. https://www.sciencedirect.com/science/article/abs/pii/S0304383508008689?v ia%3Dihub
- Chen, C. J., Yu, M. W., Liaw, Y. F. (1997). Características epidemiológicas y factores de riesgo del carcinoma hepatocelular. Wiley Online Library, 12 (9-10), S294-308. https://onlinelibrary.wiley.com/doi/abs/10.1111/j.14401746.1997.tb00513.x?s id=nlm%3Apubmed
- Yu, M. C., Yuan, J. M. (2004). Factores ambientales y riesgo de carcinoma hepatocelular. Gastroenterology, 127 (5 supl 1), S72-8. https://www.gastrojournal.org/article/S0016–5085(04)01597–5/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
- Su, Y. et al. (2018). Factores de riesgo del carcinoma hepatocelular según edad, sexo y estado de enfermedad hepática: un estudio de cohorte prospectivo en Corea. Cancer, 124(13), 2748-2757. https://acsjournals.onlinelibrary.wiley.com/doi/10.1002/cncr.31406
- Benson, A. B., D’Angelica, M. I., Abbott, D. E. et al. (2021). Cánceres hepatobiliares, versión 2.2021, Pautas de práctica clínica en oncología de la NCCN. JNCCN, 19 (5), 541-565. https://jnccn.org/configurable/content/journals$002fjnccn$002f19$002f5$002 farticlep541.xml?t:ac=journals%24002fjnccn%24002f19%24002f5%24002fa rticle–p541.xml
- Fattovich, G., Stroffolini, T., Zagni, I., Donato, F. (2004). Carcinoma hepatocelular en cirrosis: incidencia y factores de riesgo. Gastroenterology, 127 (5 Suppl 1), S35-50. https://www.gastrojournal.org/article/S0016–5085(04)01593–8/fulltext?referrer=https%3A%2F%2Fpubmed.ncbi.nlm.nih.gov%2F
- Nault, J. C., Paradis, V., Ronot, M., Zucman-Rossi, J. (2022). Tumores hepáticos benignos: comprensión de la fisiología molecular para adaptar el tratamiento clínico. Nature Reviews Gastroenterology & Hepatology, 19(11), 703-716. https://www.nature.com/articles/s41575–022–00643–5
- Desjonqueres, E., Campani, C., Marra, F., Zucman-Rossi, J., Nault, J. C. (2022). Lesiones preneoplásicas en el hígado: perspectivas moleculares y relevancia para la práctica clínica. Wiley Online Library, 42 (3), 492-506. https://onlinelibrary.wiley.com/doi/10.1111/liv.15152
- Paradis, V. (2021). Carcinomas hepatocelulares: hacia un abordaje patomolecular. Open Evidence, 41 Suppl 1, 83-88. https://www.openevidence.com/ask/d0c37894–9ab6–450b–a52bc44b0d7838c9
- Montalvo-Javé, E. et al. (2021). Actualidades en la sobrevida del carcinoma hepatocelular. Cirugía y Cirujanos, 89(1). https://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S2444054X2021000100104
- Motta Ramírez, G. A. et al. (2012). Caracterización de lesiones hepáticas focales con tomografía computada multidetector. Anales de Radiología México, 1, 46-58. https://www.medigraphic.com/pdfs/anaradmex/arm–2012/arm121g.pdf
- Illescas-Cárdenas, J., Rodríguez-Nava, P., Dena-Espinoza, E. (2017). Evaluación de las lesiones hepáticas mediante tomografía multifásica multicorte: propuesta de reporte estructurado. MedicGraphic, 16(2), 87-101. https://www.medigraphic.com/cgibin/new/resumen.cgi?IDARTICULO=74076
- Elmohr, M. et al. (2021). LI-RADS: review and Updates (2021). Clinical Liver Disease, 17(3). https://pmc.ncbi.nlm.nih.gov/articles/PMC8043699/
- Castrillón, G. A. et al. (2018). Agentes hepatoespecíficos, usos actuales: más allá de la caracterización de lesiones focales. Rev Argent Radiol, 82, 13-27. https://www.scielo.org.ar/scielo.php?pid=S1852–99922018000100003&script=sci_abstract
- Reig, M. et al. (2021). Diagnóstico y tratamiento del carcinoma hepatocelular. Actualización del documento de consenso de la AEEH, AEC, SEOM, SERAM, SERVEI y SETH. Medicina Clínica, 156(9), 463.e1-463.e30. https://www.sciencedirect.com/science/article/pii/S0025775320307697
- Navarrete Bolaños, K. A. et al. (2021). Carcinoma hepatocelular. Diagnóstico diferencial. Recimauc, 5(4). https://reciamuc.com/index.php/RECIAMUC/article/view/736
- Criss, C., Nagar, A. M., Makary, M. S. (2023). Carcinoma hepatocelular: diagnóstico por imagen de última generación. World J Radiol, 15(3), 56-68. https://pubmed.ncbi.nlm.nih.gov/37035828/
- Amado Cabana, S. et al. (2021). Contrastes hepatoespecíficos en la caracterización de lesiones focales hepáticas en RM: una guía para su selección e interpretación. Congreso Nacional SERAM, 1(1). https://piper.espacio–seram.com/index.php/seram/article/view/3843
- Selzer Soria, E. M., Malla, I. (2021). Tratamiento con propanolol en el síndrome de Kasabach-Merritt secundario a hemangioma hepático congénito. Caso clínico. Arch Argent Pediatr, 119(1), e65-e69. https://riu.austral.edu.ar/bitstream/handle/123456789/2319/Arch%20Argent%20Pediatr%20.%202021%20Feb%3B119%281%29%3Be65e69..pdf?sequence=1&isAllowed=y
- CT/MRI LI-RADS® v2018 CORE. https://www.acr.org/–/media/ACR/Files/RADS/LI–RADS/LI–RADS–2018Core.pdf
- Raya, M. et al. LI-RADS: Revisión del manejo de lesiones hepáticas en pacientes cirróticos o con riesgo de hepatocarcinoma. 33 Congreso Nacional Seram. https://www.piper.espacio–seram.com/index.php/seram/article/view/1472
- Guerra Condor, R. S. Empleo de LI-RADS por tomografía asociado a lesiones hepáticas en el Instituto Regional de Enfermedades Neoplásicas Centro 2021-2023. https://repositorio.uncp.edu.pe/bitstream/handle/20.500.12894/11225/T010_43777543_S.pdf?sequence=1&isAllowed=y
- Vernuccio, F. et al. (2021). A Tang and Giuseppe Brancatelli Vernuccio: Spectrum of liver lesions hyperintense on hepatobiliary phase: an approach by clinical setting. Insights Imaging, 12(1), 8. https://pubmed.ncbi.nlm.nih.gov/33432491/
- Díaz Rubia, L., Miras Ventura, J. A., Garrido Márquez, I. (2018). Caracterización de las lesiones hepáticas mediante Tomografía Computarizada Multidetector con estudio multifase. Congreso Nacional SERAM, 2(1), 34. https://piper.espacio–seram.com/index.php/seram/article/view/7227
- Lucasa, E. et al. (2014). Hepatic adenomatosis: A disease with controversial treatment. Cirugía Española, 92(4), 284-286. https://www.elsevier.es/es–revista–cirugia–espanola–36–articuloadenomatosis–hepatica–una–enfermedad–tratamiento-S0009739X13003552
- Laguna-Kirof, M. L. et al. (2024). Carcinoma fibrolamelar metastásico inusual: reporte de un caso. Revista Argentina de Radiología, 88(1), 38-42. https://www.redalyc.org/journal/3825/382577544006/html/
- Sierra, P. et al. (2012). Hepatocarcinoma y trombosis portal diagnosticados por ecografía y tomografía computada en pacientes cirróticos chilenos en un hospital público. Revista Chilena de Radiología, 18(1), 18-21. https://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0717–93082012000100005
- Hidalgo Méndez, F. (2014). Colangiocarcinoma hiliar. Rev Clín Med Fam, 7(1), 69-72. https://scielo.isciii.es/pdf/albacete/v7n1/paciente6.pdf
- Rojas Soldado, M. A., Matute, T. F. (2018). Carcinoma hepatocelular: Evaluación de la respuesta a la quimio embolización (TACE). Congreso Nacional SERAM, 33. https://www.piper.espacio–seram.com/index.php/seram/article/view/2675