Autora: Diana Marcela Bolaños Ordoñez
Tutor: Dr. Gustavo San Martín
Resumen
Los tumores neuroendocrinos del páncreas, específicamente los insulinomas, son neoplasias raras, pero potencialmente letales, que requieren un diagnóstico y tratamiento precisos. Se han reportado en una a cuatro personas por millón cada año, siendo más frecuente en varones que en mujeres, y pueden ocurrir a cualquier edad. La detección temprana y la localización exacta de estos tumores son fundamentales para la planificación del tratamiento quirúrgico y el seguimiento posoperatorio. La presentación del insulinoma es habitualmente benigna, con una masa menor a 2 cm de diámetro. Otra forma de presentación consiste en la presencia de múltiples insulinomas (10 % de los casos). En este trabajo se abordan cuatro casos clínicos de insulinoma.
Palabras clave: insulinoma, páncreas, tumores neuroendocrinos, diagnóstico, planificación, tratamiento quirúrgico.
Introducción
Los tumores neuroendocrinos del páncreas, específicamente los insulinomas, son neoplasias raras, pero potencialmente letales, que requieren un diagnóstico y tratamiento precisos. Se han reportado uno a cuatro casos por millón cada año, siendo más frecuente en varones que en mujeres. Pueden presentarse a cualquier edad.(1) La detección temprana y la localización exacta de estos tumores son fundamentales para la planificación del tratamiento quirúrgico y el seguimiento posoperatorio.(2) La presentación del insulinoma es habitualmente benigna, con una masa menor a 2 cm de diámetro. Otra forma de presentación consiste en la presencia de múltiples insulinomas (10 % de los casos). A continuación, se abordan cuatro casos clínicos de insulinoma.(3, 4)
Justificación
En este contexto, los métodos de imagen de diagnóstico, como la tomografía computada y la resonancia magnética, desempeñan un papel crucial en la evaluación de los insulinomas.(4) Sin embargo, la literatura científica muestra que la sensibilidad y especificidad de estas técnicas pueden variar de acuerdo con las características del tumor y del paciente.(5) Por lo tanto, es esencial analizar la relación entre las características imagenológicas de los insulinomas y las características clínicas y patológicas de los pacientes, con el fin de optimizar el uso de la tomografía computada y la resonancia magnética en el diagnóstico y seguimiento de estos tumores.(6)
Estado del arte
El insulinoma es el tumor neuroendocrino pancreático funcional más común, caracterizado por la hipersecreción de insulina y la consecuente hipoglucemia. Estos tumores suelen ser pequeños (<2 cm), bien delimitados y altamente vascularizados. La radiología juega un papel crucial en el diagnóstico y localización de estas lesiones mediante el empleo de tecnologías avanzadas, como la endosonografía, arteriografía, tomografía computarizada (TC), ecografía de abdomen, resonancia magnética (RM) y tomografía por emisión de positrones (PET).(7)
El objetivo principal de las técnicas radiológicas en el diagnóstico de insulinomas es lograr una localización precisa del tumor para facilitar el tratamiento quirúrgico curativo. Además, se busca optimizar la sensibilidad y especificidad de los métodos de imagen para detectar lesiones difíciles de visualizar mediante técnicas convencionales.(7)
La endosonografía
También conocida como ultrasonografía endoscópica (USE), es una técnica diagnóstica avanzada que combina la endoscopía y la ecografía para obtener imágenes detalladas de las estructuras internas del cuerpo. Este método utiliza un endoscopio flexible equipado con un transductor de ultrasonido en su extremo, lo que permite la visualización de órganos como el páncreas, ganglios linfáticos y tejidos circundantes con alta resolución y precisión.(8)
En el contexto del insulinoma, un tumor neuroendocrino pancreático raro y generalmente pequeño, la endosonografía es una herramienta diagnóstica de gran valor debido a su alta sensibilidad. Estos tumores, que suelen medir menos de 2 cm, pueden ser difíciles de detectar con técnicas convencionales como la tomografía computarizada (TC) o la resonancia magnética (RM). La endosonografía permite localizar lesiones no visibles en otros estudios, alcanzando una sensibilidad de hasta 90% en la detección de insulinomas pequeños o ectópicos.(8)
Los insulinomas aparecen característicamente como lesiones hipoecoicas, homogéneas y bien delimitadas en las imágenes de ultrasonido. Además, esta técnica permite diferenciar estas lesiones de otras patologías pancreáticas, como quistes o tumores sólidos no funcionales. La información proporcionada por la endosonografía es esencial para la evaluación prequirúrgica, ya que facilita la localización precisa del tumor y su relación con estructuras vasculares y conductos pancreáticos, optimizando así el abordaje quirúrgico.(9)
Otra aplicación clave de la endosonografía es la guía para procedimientos intervencionistas, como la punción aspirativa con aguja fina (PAAF). Este procedimiento permite obtener muestras del tumor para un diagnóstico citológico o histopatológico definitivo, lo que resulta crucial en casos de duda diagnóstica.(9)
Aunque presenta ventajas significativas, la endosonografía también tiene limitaciones. Es una técnica operadordependiente, por lo que la experiencia del profesional influye directamente en los resultados. También puede ser menos efectiva en la evaluación de lesiones ubicadas en la cola del páncreas o en áreas alejadas del tracto gastrointestinal. Sin embargo, su bajo riesgo de complicaciones y su capacidad para combinar evaluación diagnóstica y terapéutica la convierten en una herramienta indispensable en el manejo de pacientes con insulinomas.(9)
La endosonografía representa un avance significativo en la detección y manejo de insulinomas, en especial en aquellos casos difíciles de diagnosticar con métodos convencionales. Su aplicación en el diagnóstico, evaluación prequirúrgica y guía de intervenciones mínimamente invasivas subraya su importancia en el abordaje multidisciplinario de esta patología.(6)
Tomografía axial computada
Es el método diagnóstico preoperatorio no invasivo con mejor desempeño diagnóstico, con una sensibilidad de entre el 33% y el 64%.(6, 10)
Es una herramienta de imagen esencial en el diagnóstico y manejo del insulinoma, un tumor neuroendocrino pancreático funcional. Este método utiliza radiación ionizante para obtener imágenes transversales detalladas, lo que permite identificar y caracterizar lesiones pequeñas en el páncreas.(6)
En el estudio del insulinoma, la escanografía se realiza con protocolos de contraste intravenoso dinámico que incluyen la fase arterial, venosa portal y tardía. La fase arterial es crucial, ya que los insulinomas, debido a su alta vascularización, se muestran como lesiones hipervasculares en esta etapa.(6, 11) Además, suelen ser pequeñas, bien delimitadas y predominantemente localizadas en el cuerpo y la cola del páncreas, aunque pueden encontrarse en cualquier región. En la mayoría de los casos, estas lesiones son benignas y no muestran características invasivas.(12)
La TC destaca por su rapidez y accesibilidad, siendo una técnica de primera línea en la evaluación inicial del insulinoma.
Sin embargo, la escanografía presenta ciertas limitaciones. Las lesiones menores de 1 cm pueden no ser detectadas, y su uso implica exposición a radiación ionizante, lo que debe considerarse en pacientes jóvenes o con necesidades de estudios repetidos. Además, su dependencia del contraste puede ser problemática en individuos con insuficiencia renal o alergias.
En comparación con otras modalidades, como la resonancia magnética (RM) o la endosonografía, puede mostrar menor sensibilidad para lesiones pequeñas o ubicadas en regiones complejas. Por este motivo, la TC suele integrarse en un enfoque multimodal que incluye estudios funcionales como la tomografía por emisión de positrones (PET).(4)
En conclusión, la escanografía es una técnica valiosa y accesible para el diagnóstico de insulinomas. Aunque presenta ciertas limitaciones, su combinación con otras modalidades de imagen permite una evaluación integral, optimizando la localización del tumor y la planificación terapéutica.(1)
La ecografía es un método de mucha relevancia, complementario en el manejo del insulinoma. Permite, junto con la palpación bimanual, localizar la lesión señalada por los otros exámenes. Este método tiene una sensibilidad del 9%-64%, pero la combinación de la palpación del páncreas más la ecografía alcanza una sensibilidad del 100%, (7, 10) con limitaciones cuando se trata de tumores <2 cm.(6, 11)
La resonancia magnética es una técnica que presenta una sensibilidad que varía entre el 83% y 100% en masas mayores de 2 cm, y entre el 33% y el 86% en masas menores de 2 cm.(10, 7, 6)
El estado del arte en radiología para insulinomas refleja avances significativos en tecnologías de imagen, mejorando la capacidad diagnóstica y facilitando el manejo clínico. La integración de nuevas técnicas, como PET-CT y herramientas de inteligencia artificial, representa el futuro prometedor en este campo, optimizando los resultados para pacientes con esta patología.
Marco teórico
Los insulinomas son considerados tumores benignos de origen neuroendocrino que derivan de las células beta de los islotes de Langerhans pancreáticos y se caracterizan por la secreción autónoma de insulina de un tumor neuroendocrino del páncreas. Se considera que generan episodios de hipoglucemia de repetición. Son el tipo más común de tumores neuroendocrinos pancreáticos funcionales, pero se les considera raros en términos absolutos, con una incidencia estimada de entre uno y cuatro casos por millón de habitantes y por año.(14)
En general, los insulinomas se presentan a partir de la cuarta y hasta la sexta década de la vida, pero también existen casos reportados de insulinomas en población pediátrica y adolescente. No se describe una clara preferencia por el sexo, pues converge en varones y en mujeres la incidencia.
Aproximadamente el 90% de los insulinomas son tumores benignos y el 10% recibe la consideración de malignos, con metástasis fundamentalmente en el hígado y en los ganglios linfáticos regionales.(10)
El 5% de los casos de insulinomas se asocian con un síndrome de neoplasia endocrina múltiple, un trastorno hereditario de tipo autosómico dominante que también predispondría a presentar otros tumores endocrinos, como gastrinomas, adenomas paratiroideos y tumores hipofisarios.(15)
El diagnóstico en fase precoz es crucial para evitar complicaciones severas de las hipoglucemias repetidas. En lo que respecta al ámbito geográfico, no se han detectado diferencias significativas en relación con la incidencia de los insulinomas para diferentes regiones del mundo.(15)
Fisiología
Los insulinomas son un tumor neuroendocrino funcional de las células beta de los islotes de Langerhans del páncreas, cuyas únicas funciones son la síntesis y la secreción de insulina. Se caracterizan por una secreción inadecuada y autónoma de insulina en base a los niveles de glucosa en sangre, generando hipoglucemias de repetición. La secreción de insulina en condiciones normales es controlada por los niveles de glucosa; cuando aumentan los niveles de glucosa, tal como ocurre después de la ingesta de alimentos, las células beta liberan insulina para facilitar la captación de glucosa por los tejidos periféricos y mantener la homeostasis glucémica.(16)
Los insulinomas presentan una alteración de este mecanismo regulador debido a las mutaciones genéticas que afectan a las vías intracelulares responsables de la regulación hormonal, bien por defectos del propio gen, como ocurre en el caso del síndrome de neoplasia endocrina múltiple tipo 1 (MEN1), o indiferentemente con las proteínas reguladoras del ciclo celular.(16)
La hipersecreción de la insulina por parte del tumor da lugar a una disminución excesiva del nivel de glucosa en sangre (hipoglucemia), lo que a su vez activa las contrarregulaciones hormonales, tales como glucagón, epinefrina y cortisol, siendo sin embargo importante recordar que en situaciones de hipoglucemia crónica tal respuesta queda atenuada, lo que daría lugar a algunos de los síntomas neuroglucopénicos, como confusión, debilidad muscular, visión borrosa, convulsiones y hasta pérdida de la conciencia.(17)
Desde el punto de vista fisiológico, el exceso de insulina potenciado por el tumor origina un incremento de la captación de glucosa por los músculos y tejidos adiposos, inhibición del metabolismo de los precursores del glucógeno o de la gluconeogénesis y una estimulación de la lipogénesis, lo que puede dar lugar a un porcentaje de incremento del peso en algunos de los pacientes insulinorresistentes. Todo ello, junto con la hipoglucemia, es lo que explica los síntomas típicos y los cambios metabólicos que se producen en dicha enfermedad.(18)
Tejido pancreático
El páncreas es un órgano situado en retroperitoneal, en el que podemos distinguir la existencia de un tejido exocrino, que es el responsable de producir las enzimas digestivas, y un tejido endocrino, que permite secretar las hormonas que son esenciales para muchos de los procesos metabólicos del ser humano. Pesa entre 70 y 100 gramos en los humanos adultos.(19)
El tejido pancreático se divide en:
- Tejido exocrino (85%-90% del páncreas): comprende los acinos pancreáticos, que producen y secretan enzimas digestivas, como la amilasa, las lipasas y las proteasas, que serán transportadas al intestino delgado a través del sistema de los conductos, en el que entra también a formar parte de la digestión de los nutrientes dentro del lumen intestinal.
- Tejido endocrino (1%-2% del páncreas): el tejido endocrino del páncreas está formado por los islotes de Langerhans, que son estructuras que contienen los diferentes tipos celulares:
- Células alfa (20%-30%): secretan glucagón, que es una hormona contrarreguladora.
- Células beta (60%-70%): producen insulina, que es la hormona responsable de regular la glucosa.
- Células delta: secretan somatostatina, que influye en la secreción de insulina y glucagón.
- Células PP (células F): secretan polipéptido pancreático, participando en la regulación de la función gastrointestinal.(20)
Insulina
La insulina es una hormona peptídica que se origina y se secreta en las células beta de los islotes de Langerhans del páncreas endocrino. Se trata de la principal hormona anabólica del organismo, y su función primordial es la de regular los niveles de glucosa en sangre, favoreciendo su captación por los tejidos y fomentando el almacenamiento de energía en forma de glucógeno, grasas y proteínas. De esta manera, la insulina tiene un papel preponderante en el metabolismo que sustenta los carbohidratos, lípidos y proteínas.(21)
Estructura
La insulina es un péptido constituido por dos cadenas polipeptídicas (cadena A y cadena B), unidas por dos puentes disulfuro. La cadena A contiene 21 aminoácidos, mientras que la cadena B tiene 30 aminoácidos, lo que hace un total de 51 aminoácidos. Se sintetiza inicialmente como preproinsulina, la cual es una molécula precursora que experimenta modificaciones postraduccionales para acabar transformándose en insulina activa y péptido C.(21)
Síntesis y secreción
Síntesis: se produce en las células beta del páncreas. La insulina inicialmente se produce como preproinsulina, que posteriormente deviene en proinsulina y finalmente en insulina activa.(22)
Secreción: está sobre todo influenciada por altos niveles de glucosa en sangre (>100 mg/dL). Se producen otros estímulos, como los aminoácidos (arginina y leucina), hormonas gastroentéricas (GLP-1 y GIP) y estímulos vagales (acetilcolina). Se excreta en la circulación sanguínea en pulsos regulares basales y en respuesta a la ingesta de alimentos.(22)
Funciones fisiológicas
Metabolismo de carbohidratos. Facilita la captación de glucosa por los tejidos sensibles a la insulina (músculo esquelético y tejido adiposo) mediante la estimulación de la translocación de los transportadores de glucosa (GLUT-4) al nivel de la membrana celular. También estimula la síntesis de glucógeno (glucogénesis) en hígado y músculo e inhibe la gluconeogénesis y la glucogenólisis hepática.(23)
Metabolismo de lípidos. Estimula la síntesis de ácidos grasos (lipogénesis) en el tejido adiposo, inhibe la lipólisis, reduciendo la liberación de ácidos grasos libres en sangre. En cuanto a metabolismo de proteínas, favorece la síntesis proteica al estimular la captación de aminoácidos por las células e inhibe el catabolismo proteico.(24)
Regulación
Estimulantes de la secreción de insulina dependen de los niveles elevados de glucosa, aminoácidos, hormonas gastrointestinales (como GLP-1 y GIP) y acetilcolina. En relación con estímulos inhibidores, los niveles bajos de glucosa, hormonas contrarreguladoras (glucagón, epinefrina, cortisol y hormona del crecimiento) y somatostatina bajan su presencia en la sangre.(19)
Vida media
La insulina tiene una vida media corta, de aproximadamente 5-10 minutos en circulación. Es metabolizada principalmente por el hígado y los riñones.(20)
Funciones clínicas y terapéuticas
Es esencial para mantener la homeostasis glucémica. Su deficiencia o ausencia total conduce a diabetes mellitus tipo 1, mientras que su resistencia está asociada con diabetes mellitus tipo 2. Se utiliza en terapia para tratar diabetes mellitus (tipos 1 y 2), estados de hiperglucemia severa (cetoacidosis diabética), y en ciertos casos, en nutrición parenteral o manejo de hiperkalemia (porque estimula la captación de potasio por las células).(15)
Tipos farmacológicos
- Insulina de acción rápida (ej. insulina lispro, aspart).
- Insulina de acción intermedia (ej. NPH).
- Insulina de acción prolongada (ej. insulina glargina, detemir).
- Insulinas mixtas (combinación de insulinas de diferentes duraciones).
Glucagón
El glucagón se considera una hormona del tipo péptido. Está secretado por las células alfa de los islotes de Langerhans del páncreas endocrino. Contribuye a mantener las concentraciones de glucosa en sangre dentro de los límites adecuados, en especial en los estados de ayuno o de hipoglucemia. En cierto sentido, la hormona glucagón actúa como una hormona contrarreguladora de la insulina, induciendo procesos catabólicos que incrementan la disponibilidad de glucosa para las células.(24)
Características principales del glucagón
Estructura. El glucagón es un polipéptido lineal de 29 aminoácidos. Su peso molecular es de alrededor de 3,485 Da. Es sintetizado inicialmente como preproglucagón en las células alfa del páncreas y mediante modificaciones postraduccionales se convierte en el glucagón activo.(23)
Síntesis y secreción. Se produce en las células alfa del páncreas a partir del gen GCG, el que no solo se ocupa de sintetizar el glucagón, sino también otras proteínas tales como el péptido similar al glucagón 1 (GLP1) y el GLP2 en el intestino. Se libera en respuesta a niveles bajos de glucosa en sangre (valores por debajo de los 70 mg/dL). Entre otros estímulos que inducen la secreción del glucagón se encuentran el aumento de concentración de aminoácidos en sangre (es el caso de la arginina y la alanina), la secreción de hormonas del estrés (entre las que encontramos la adrenalina o el cortisol), así como la actividad del ejercicio físico. Los niveles altos en glucosa, insulina, somatostatina y GLP-1 generan efecto inhibitorio.(25)
Receptores. El glucagón actúa mediante la unión a sus receptores específicos, que están acoplados a proteína G (los receptores del glucagón) y que se encuentran localizados principalmente en el hígado, pero también de manera menos significativa en el riñón y en el tejido adiposo. Estos receptores, a su vez, inducen la activación de la adenilato ciclasa, que aumenta los niveles intracelulares de AMP cíclico (AMPc), lo que incrementa la cantidad de proteína quinasa A (PKA) y desencadena así las acciones atribuibles al glucagón.(25)
Funciones principales del glucagón
Actúa principalmente en el hígado; promueve los procesos catabólicos de glucosa para mantener la homeostasia de glucosa, en el hígado se origina la glucogenólisis que estimula la degradación del glucógeno en glucosa, que seguidamente se libera a la circulación.(26)
Gluconeogénesis: promueve la síntesis de glucosa a partir de precursores no glucídicos, como lactato, glicerol y aminoácidos. La inhibición de la glucogénesis evita la síntesis de glucógeno a partir de la glucosa.(26)
En el tejido adiposo, estimula la lipólisis, estimula la degradación de triglicéridos en ácidos grasos libres y glicerol, que pueden ser utilizados como fuentes de energía o para la gluconeogénesis en el hígado.
En el corazón y el músculo esquelético, aunque el glucagón no tiene un papel directo sobre estos tejidos, el aumento de ácidos grasos libres y cuerpos cetónicos proporciona energía alternativa durante el ayuno prolongado.
Regulación del metabolismo de lípidos: en el hígado, el glucagón promueve la oxidación de ácidos grasos y la producción de cuerpos cetónicos, especialmente durante estados de ayuno prolongado o cetosis.(26)
Regulación de la secreción de glucagón
Estímulos que aumentan la secreción: encontramos hipoglucemia, que es el principal estímulo fisiológico. Además, hay incremento de aminoácidos en sangre, como alanina y arginina (importante tras comidas ricas en proteínas). Las hormonas del estrés, como la adrenalina y el cortisol, potencian su liberación en situaciones de estrés o ejercicio intenso. También la activación del sistema nervioso simpático estimula la secreción de glucagón.(27)
Estímulos que disminuyen la secreción: los altos niveles de glucosa inhiben la liberación de glucagón. La insulina tiene un efecto directo inhibitorio sobre las células alfa. También la somatostatina, que es secretada por las células delta del páncreas, inhibe tanto la insulina como el glucagón. El GLP-1 (péptido similar al glucagón-1), aunque derivado del mismo gen que el glucagón, actúa como inhibidor de su secreción.(28)
Somatostatina
Fisiología de la somatostatina
La somatostatina es un compuesto peptídico que tiene un papel exitoso en la regulación de los procesos metabólicos, endocrino y de la motilidad gastrointestinal. Es producida por las células delta del páncreas, las células neuroendocrinas del tubo digestivo y las neuronas específicas del sistema nervioso central (SNC). Su función es principalmente inhibitoria, actuando sobre una amplia variedad de sistemas endógenos mediante la modificación de las secreciones hormonales y enzimáticas.(29)
Estructura
La somatostatina existe en dos formas activas: la somatostatina-14 y la somatostatina-28, ambas resultantes de un precursor común llamado prosomatostatina. La somatostatina-14 es la forma que prevalece en el páncreas y en el SNC, mientras que la somatostatina-28 se devuelve en el tubo digestivo.
Estas formas isoactivas pueden tener un efecto unas sobre otras mediante la unión a cinco subtipos de receptores acoplados a proteínas G (SSTR1-SSTR5), cuya distribución es variada entre los diferentes tejidos. La activación de dichos receptores interfiere con la adenilato ciclasa y, por lo tanto, disminuye los niveles intracelulares de AMPc y modifica diferentes funciones celulares.(30)
En el páncreas la somatostatina controla la interacción de las hormonas glucagón e insulina, inhibiendo la secreción de ambas y participando de este modo en la homeostasis glucémica. En el tubo digestivo, por el contrario, disminuye la secreción de ácido clorhídrico, enzimas pancreáticas y hormonas como la gastrina, la secretina y la colecistoquinina. También disminuye la motilidad del aparato digestivo y la absorción de nutrientes. En el SNC, la somatostatina ejerce funciones de neurotransmisor, modula la actividad del sistema nervioso, controla el ciclo sueño/vigilia o la secreción de la hormona del crecimiento (GH) por la hipófisis.(30)
Secreción
La secreción de somatostatina está controlada por diversos estímulos. La elevación de glucosa, aminoácidos y determinadas hormonas gastrointestinales, como la colecistoquinina, favorecen su liberación. La presencia de insulina, glucagón y somatostatina interfiere en un mecanismo de cross-talk que inhibe su secreción. La importancia clínica de la somatostatina radica en su papel central como regulador inhibitorio.
En condiciones patológicas, como en tumores secretores de somatostatina (somatostatinomas), se pueden observar síntomas de hipoglucemia, hipoclorhidria y esteatorrea. Además, los análogos de somatostatina, como el octreótido, tienen aplicaciones terapéuticas en el tratamiento de tumores neuroendocrinos, acromegalia y hemorragias gastrointestinales.(31)
Regulación de la glucosa
La homeostasis de la glucosa en sangre es fundamental para el metabolismo energético, y depende de un equilibrio entre la secreción de insulina y las hormonas contrarreguladoras (como el glucagón, la epinefrina, el cortisol y la hormona del crecimiento).(32)
Acción de la insulina:
- La insulina, secretada por las células beta en respuesta a niveles elevados de glucosa en sangre, reduce la glucemia mediante:
- Aumento de la captación de glucosa en tejidos sensibles a la insulina, como el músculo esquelético y el tejido adiposo.
- Estimulación de la síntesis de glucógeno (glucogénesis) en el hígado.
- Inhibición de la gluconeogénesis y glucogenólisis hepática.
- Promoción de la lipogénesis y almacenamiento de ácidos grasos.(32)
Acción del glucagón:
- Secretado por las células alfa en respuesta a niveles bajos de glucosa, el glucagón aumenta la glucemia al:
- Estimular la glucogenólisis hepática (degradación del glucógeno en glucosa).
- Activar la gluconeogénesis (síntesis de glucosa a partir de precursores no glucídicos).(32)
Interacción insulina-glucagón
La insulina y el glucagón trabajan en equilibrio dinámico para mantener la glucosa en sangre dentro de un rango normal (70-110 mg/dL en ayuno). Este sistema está modulado por señales del sistema nervioso autónomo y hormonas gastrointestinales, como el péptido similar al glucagón tipo 1 (GLP-1), que potencia la secreción de insulina posprandial.(33)
Determinaciones patológicas
Las alteraciones en este sistema de regulación pueden dar lugar a hipoglucemia (por ejemplo, en el caso de los insulinomas) o hiperglucemia crónica (por ejemplo, en el caso de la diabetes mellitus).(33)
Determinaciones de riesgo
El insulinoma es un tumor neuroendocrino infrecuente, y sus determinantes de riesgo no son completamente desvelados. Sin embargo, existen ciertas entidades genéticas y factores esperados que pueden contribuir a su acumulación. Entre los determinantes de riesgo fundamentales, se mencionan:(34)
Síndrome de neoplasia endocrina múltiple tipo 1 (MEN-1)
Aproximadamente entre el 5%-10% de los insulinomas presentan relación a MEN-1, enfermedad hereditaria autosómica dominante provocada por mutaciones del gen MEN1, causante de la proteína menina. Esta enfermedad predispone a la acumulación de múltiples tumores endocrinos, como insulinomas, gastrinomas y adenomas paratiroideos.(34, 35)
Predisposición genética
A pesar de que la mayor parte de los insulinomas se presentan de manera esporádica, algunos estudios han denunciado que ciertas mutaciones de los genes en vías de proliferación celular pueden estar implicados, como mutaciones en el gen mTOR o en proteínas reguladoras del ciclo celular.(36)
A pesar de que el riesgo es similar en varones y mujeres, la mayoría de los casos de insulinoma se presentan en personas entre los 40 y los 60 años. No obstante lo anterior, también se han documentado casos en niños y adolescentes, en especial en relación con MEN-1.(36)
Enfermedades pancreáticas
Aunque no se consideran un determinante causal directo, se ha especulado que entidades que pueden impactar en la estructura y en el funcionamiento del páncreas, como la pancreatitis crónica, podrían relacionarse con un mayor riesgo de tumores neuroendocrinos pancreáticos, y esta relación no ha sido desvelada para los insulinomas.(37)
Factores del entorno o desconocidos
Como la mayoría de los insulinomas se presentan de forma esporádica, se han planteado supuestos de que factores relacionados con el medio ambiente, de tipo epigenético o bien moleculares no todavía denunciados puedan estar intervinientes en su acumulación.(37, 38)
Objetivos
Objetivo general
Evaluar la eficacia e importancia de los métodos de imagen tomografía computada y resonancia magnética en el diagnóstico de tumores neuroendocrinos del páncreas (insulinomas).
Objetivos específicos
- Identificar las características imagenológicas de los insulinomas en tomografía computada y resonancia magnética.
- Resaltar el papel de la tomografía computada y resonancia magnética en la planificación del tratamiento quirúrgico de los tumores neuroendocrinos (insulinomas).
- Comparar la eficacia de la tomografía computada y resonancia magnética en la detección de insulinomas en diferentes localizaciones pancreáticas.
- Analizar la correlación entre las características imagenológicas y las características clínicas y patológicas de los tumores neuroendocrinos (insulinomas).
Reporte de casos
Caso 1
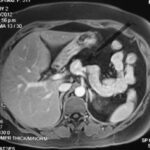
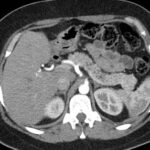
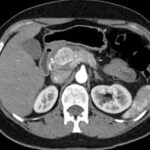
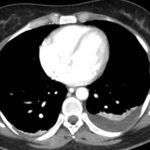
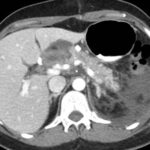
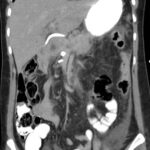
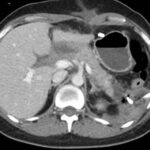
Paciente femenina de 50 años de edad con antecedentes de HTA. Anexo histerectomía total por carcinoma de útero, apendicetomía, colecistectomía, cesárea, resección de tumor basocelular. Derivada de Hospital Regional Dr. Luis Pasteur de Villa María de Córdoba el 21 de marzo de 2021 a Hospital Sanatorio Franchin por cuadro de hipoglicemias severas sintomáticas a repetición, con laboratorios clínicos donde se observó hipoglicemia asociada a hiperinsulinismo; el péptido C se encontraba elevado. Se realizó imágenes (TAC, RMN) que evidenciaban lesión en región de cabeza de páncreas medial con refuerzo arterial, compatibles en primera instancia con insulinoma. Se decide conducta quirúrgica debido a clínica, realizándose el día 27 de abril de 2021 duodeno pancreatectomía, evolucionó con fístula pancreática con requerimiento de octreotide. Posteriormente se realizó seguimiento de la paciente sin evidencia de síntomas de hiperinsulinismo, y en los controles radiológicos no se encontró recurrencia.
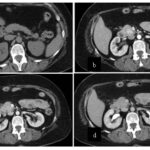
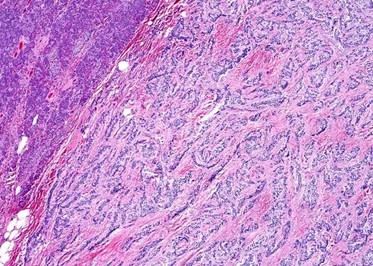
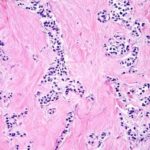
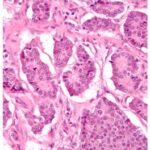
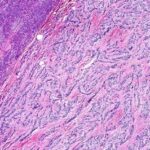
Estudio histopatológico reveló tumor neuroendocrino bien diferenciado grado 1, márgenes libres con ausencia de metástasis.
Caso 2
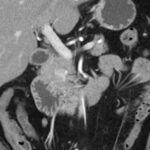
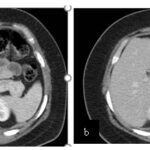
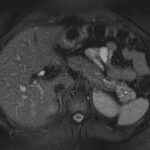
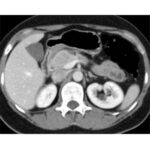
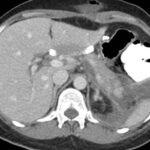
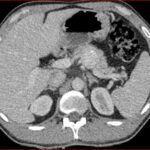
Paciente femenina de 48 años de edad que ingresa a Hospital Sanatorio Franchin por síntomas de cefalea y mareos, cuadro que se hace progresivo, presentando síncopes y posteriormente alteración del estado de conciencia. Los exámenes clínicos revelan una glucosa de 40 mg/dl, concomitante con insulina alta y péptido C elevado. Ingresa de forma programada para realización de duodeno pancreatectomía el 29 de mayo de 2021. Imágenes diagnósticas muestran estudio trifásico de tomografía de abdomen, lesión nodular en la cabeza del páncreas con ávido realce en fase arterial que en resonancia magnética se observa hiperintensa en T2, presenta restricción con la difusión y caída de la señal en el ADC. Además presenta realce tras la administración de contraste con gadolinio.
Estudio histopatológico reveló tumor neuroendocrino bien diferenciado grado 1.
Caso 3
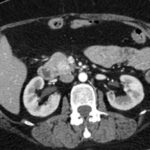
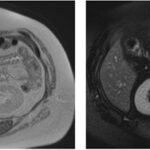
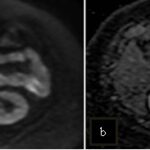
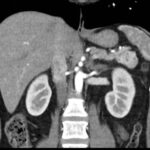
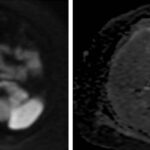
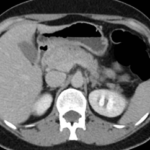
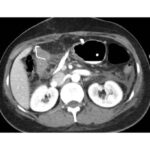
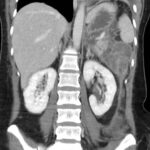
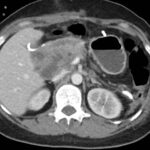
Mujer de 36 años que ingresa a Hospital Sanatorio Franchin el 11 de octubre de 2023 de forma programada para realización de duodeno pancreatectomía cefálica por tumor de cabeza de páncreas en estudio. Refiere hallazgo de lesión en forma incidental durante estudio de control hace dos meses por presentar antecedentes familiares (neoplasia endocrina múltiple). Se interna para manejo quirúrgico. Estudios de tomografía revelan formación nodular localizada en cabeza y cuerpo pancreático de paredes gruesas que mide 24 x 28 mm, que en resonancia se muestra hiperintensa en T2 y realce periférico luego de la administración de contraste endovenoso. Presenta restricción en la difusión con caída de la señal ADC, por lo que se vincula con una lesión de alta celularidad.
Laboratorios clínicos: Hto: 42 HB: 14.1 GB: 4200 Plaq: 231mil Glu: 90 Péptido C: 3.5 TGO: 17 TGP: 28 BT: 0.75 Fal: 179 Glucemia 109 TP: 100% KPTT: 36 Prots tots: 6.5 AlB 4.43.
Se le practica una duodeno pancreatectomía cefálica y triple anastomosis (hepato yeyuno, gastroentero y wirsung enteroanastomosis) el 12 de octubre de 2023 y pasa a internación UTI, el 14 de octubre se complica con fiebre, dolor abdominal y fístula pancreática con dosaje de amilasa de drenaje >6000, por lo que se le realiza tomografía que muestra abundante líquido libre en cavidad. Por tal motivo se le realiza una exploración quirúrgica por laparotomía, encontrándose abundante líquido + pancreatitis en la anastomosis yeyuno pancreática. Se realiza lavado de cavidad + 3 drenajes abocados a zona pancreática + yeyunostomia.
Paciente que se intuba y pasa a UTI, posteriormente extubación exitosa. El 22 de octubre se complica con colección abdominal, por lo cual requiere de drenaje percutáneo guiado por TC.
Paciente con evolución clínica favorable, el día 29 de octubre de 2023 se da egreso.
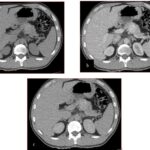
Tomografía de abdomen y pelvis con cte ev: del 13/10/2023.
Complicaciones posquirúrgicas
Tomografía de abdomen con cte ev: del 20/10/2023.
Complicaciones posquirúrgicas
Tomografía de abdomen con cte ev: del 26/10/2023.
Estudio histopatológico reveló neoplásica de estirpe neuroendocrina bien delimitada.
Caso 4
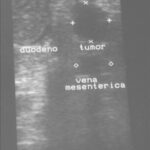
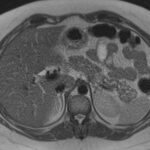
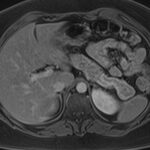
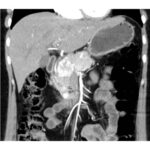
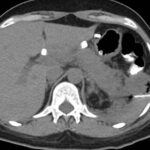
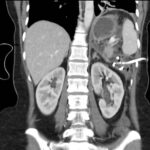
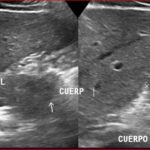
Paciente masculino de 35 años de edad, con antecedentes de tabaquismo, etilismo, consumo de sustancias psicoactivas. Ingresa al hospital de Sanatorio Franchin el 24 de mayo de 2024, donde se constata hipoglucemia severa con buena respuesta al glucosado hipertónico endovenoso. Al examen físico con la típica tríada de Whipple, dado por síntomas neuroglucopénicos de alteración del estado de conciencia, glucemia de 25 mg/dl y alivio sintomático después de la administración de glucosa. El paciente recupera el estado de conciencia y refiere dolor abdominal a nivel de epigastrio, por lo que se le realiza ecografía abdominal, donde se evidencia lesión nodular hipoecogénica en cuerpo del páncreas. Por esta razón se pasa al paciente a tomografía, donde se constata una formación nodular a nivel del cuerpo del páncreas, que presenta un ávido realce en fase arterial con homogeneización de la lesión en tiempo tardío.
Discusión
El insulinoma, “el pequeño alborotador”, como en algunos artículos se lo describe, es un tumor neuroendocrino poco frecuente. Los estudios de imagen, tomografía y resonancia magnética como métodos no invasivos, juegan un papel fundamental en el diagnóstico y planificación de un tratamiento a seguir.
Estos tumores funcionales poco frecuentes, de mayor prevalencia en mujeres que hombres, datos de la literatura que concuerdan con esta revisión, ya que la incidencia fue baja en un período de tres años en mi caso, y de mayor proporción en mujeres, datos muy concordantes con los artículos revisados.
La gran mayoría de los pacientes presentan una clínica muy particular, con síntomas neuroglucopénicos y la típica triada de Whipple (síntomas de hipoglucemia, glucemia menor de 40 mg/dl, corrección de los síntomas después de una carga de glucosa). Ante estos hallazgos clínicos y de laboratorio se debe realizar nuestra primera impresión diagnóstica y empezar la búsqueda de este tumor. De esta manera podemos decir que el enfoque inicial del paciente depende mucho de su sintomatología, y es aquí donde existen dos pasos cruciales para evaluar un insulinoma. El primero es establecer el diagnóstico con pruebas bioquímicas cuando existe una alta sospecha clínica, y el segundo es localizar el tumor.
Referente a las pruebas bioquímicas, el ayuno de 72 horas es la prueba estándar para diagnosticar el insulinoma que, en combinación con otras pruebas, como glucosa en suero, niveles de insulina en ayunas, índice de insulina/glucosa, proinsulina y péptido C, aumentan la sensibilidad diagnóstica.
Una vez que tengamos una fuerte sospecha diagnóstica basada en la clínica y el laboratorio bioquímico viene la localización del tumor, que se puede realizar a través de métodos no invasivos, como la ecografía, que como método de abordaje inicial no está mal para una primera exploración, pero debemos conocer que su sensibilidad es muy baja, del 9%. Pero como un estudio no invasivo, rápido, relativamente económico, y si está disponible en nuestro servicio, se puede utilizar. Los insulinomas se pueden observar por este método como una imagen nodular hipoecogénica que puede mostrar ante la presencia de Doppler color un patrón periférico o centrípeto, porque recordemos que estos son tumores hipervasculares, lo que significa que tienen una alta densidad de vasos sanguíneos.
Ahora bien, como se mencionaba al principio, el estudio ecográfico es de muy baja sensibilidad y se identifique o no la lesión por este estudio, nuestro siguiente paso en el algoritmo diagnóstico de esta lesión es la tomografía. Esta es la prueba no invasiva inicial, con una sensibilidad del 63% al 83%, y detecta del 70% al 80% de los tumores. Esta debe realizarse como un estudio trifásico: fase arterial temprana a los 30 segundos, fase venosa a los 70 segundos, fase tardía de 3 a 5 minutos. La característica de estos tumores por tomografía es que se presentan como una masa sólida que tiene un ávido realce en la fase arterial, cuyo realce se mantiene y se observa más tenue en la fase venosa y en los tiempos tardíos la lesión se homogeniza.
La resonancia magnética es el otro estudio de imagen no invasivo que nos permite la detección de la lesión con una sensibilidad mayor que la de la tomografía, del 85% al 95%, donde los insulinomas presentan un realce tras la administración de contraste con gadolinio y secuencias T1 sin contraste son lesiones hipointensas y en secuencias T2 son hiperintensas.
Para mi caso, y dando una visión general de los métodos de imagen no invasivos en esta revisión retrospectiva, solo a uno de los pacientes se le detectó la lesión por ecografía, donde se visualizó una lesión nodular hipoecogénica en el cuerpo del páncreas. A los demás pacientes se les detectó la lesión por tomografía en estudio trifásico, donde resaltan las características ya descritas por la literatura de lesiones hipervasculares con intenso realce en fase arterial, localizadas en diferentes partes del páncreas, como cabeza, cuerpo y cola.
La resonancia magnética confirmó aún más el diagnóstico de las lesiones ya previamente visualizadas en tomografía en esta revisión, con realce de las lesiones en secuencias T1 y contraste con gadolinio, y en las secuencias funcionales con restricción de la lesión y caída de la señal en el mapa de ADC.
Una vez detectada la lesión por cualquiera de estos métodos no invasivos, el tratamiento es netamente quirúrgico. Entonces sabemos que la técnica quirúrgica es una técnica dependiente de la imagen para su planificación, ya que estas definen el éxito y precisión de la cirugía y minimizan el riesgo de complicaciones.
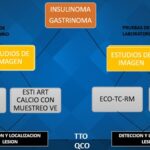
Ahora bien, ¿qué pasa si esta lesión no puede ser identificada por cualquiera de estos métodos no invasivos, pero existe la sospecha clínica y bioquímica? La literatura actual reporta métodos de imagen invasivos con una alta sensibilidad y de gran ayuda en el diagnóstico de estos tumores, y en especial los de menor tamaño, como es la prueba de estimulación de calcio intraarterial con muestreo venoso hepático, que se considera el gold standard para la detección de estas lesiones. En este apartado dejamos una brecha para futuras investigaciones y trabajos acerca de estos métodos, que nos muestren sus beneficios, complicaciones y riesgos.
Por último, no debemos olvidar que unos de los diagnósticos diferenciales del insulinoma es el gastrinoma, tumor neuroendocrino de las células de los islotes no beta que secreta gastrina, lo cual lleva a una producción excesiva de ácido gástrico, lo que causa una enfermedad ulcerosa péptica grave y diarrea, una combinación que se conoce como síndrome de Zollinger-Ellison. Hallazgos clínicos y de la fisiopatología que nos ayudan a orientar un diagnóstico inicial y aunque por los métodos de imágenes no invasivos muchas veces sea difícil diferenciar una condición de la otra, la localización de ambas lesiones es crucial para un tratamiento exitoso.
A continuación, se muestra un flujograma para el abordaje inicial del insulinoma y su diagnóstico diferencial el gastrinoma.
Conclusiones
La tomografía computarizada y la resonancia magnética son herramientas valiosas para detectar y caracterizar insulinomas del páncreas. La resonancia magnética es más sensible que la tomografía para detectar estos tumores. Pero aún más la combinación de ambos métodos de imagen aumenta la sensibilidad y especificidad para la detección de estas lesiones. En esta revisión se logró identificar las lesiones ubicadas en diferentes partes del páncreas tanto por tomografía como por resonancia magnética, con una buena caracterización de las imágenes, lo que permitió avanzar hacia un tratamiento.
La detección temprana del insulinoma es crucial para evitar complicaciones relacionadas con la hipoglucemia. Es por ello que es muy importante el abordaje inicial del paciente, empezando por su sintomatología clínica, seguido de un laboratorio bioquímico que nos permita establecer nuestra primera impresión diagnóstica inicial y sobre la base de ello iniciar la búsqueda y localización de la lesión a través de estudios de imagen no invasivos, como son la tomografía y la resonancia magnética, que nos permiten la detección de la lesión. Y en relación con ello realizar una planificación prequirúrgica, que constituye la base del tratamiento, con lo cual se reduce la morbilidad y se minimiza el riesgo de complicaciones.
Bibliografía
- Okabayashi, T., Shima, Y., Sumiyoshi, T., Kozuki, A., Ito, S., Ogawa, Y. et al. (2013). Diagnosis and management of insulinoma. World J Gastroenterol WJG, 19(6), 829-837.
- Zhu, L., Xue, H., Sun, H., Wang, X., Wu, W., Jin, Z. et al. (2017). Insulinoma Detection With MDCT: Is There a Role for Whole-Pancreas Perfusion? Am J Roentgenol, 208(2), 306-314.
- Machicado Rivero, L. E. (2023). Insulinoma: reporte de un caso con resección quirúrgica exitosa. Horiz Méd Lima, 23(4).
- Trigueros, J. P. J. (2014). Insulinoma: diagnoóstico y manejo. Revista Médica de Costa Rica y Centro América, (613), 845-847.
- Marazuela, M., Martín-Pérez, E., Larrañaga, E. (2005). Diagnóstico y tratamiento del insulinoma: nuestra experiencia en 10 casos, 52, 7(338), 43.
- Medina-Zamora, P. Pablo Medina-Zamora y Jorge Omar Lucio-Figueroa (2016).
- Giraldo, J. A., Melo, M., Abadía, M., Pantoja, D., Garavito, G., Mesa, J. et al. (2008). Insulinoma del páncreas: reporte de tres casos y discusión.
- Mosquera-Klinger, G., Carvajal-Gutiérrez, J. J., Gómez-Venegas, Á. A-, Niño-Ramírez, S., Cañadas-Garrido, R., Mosquera-Klinger, G. et al. (2020). Endoscopic ultrasound: Current applications to approach gastrointestinal solid tumors. Revista Colombiana Gastroenterol, 35(4), 506-518.
- Priego, P., Sanjuanbenito, A., Martínez Molina, E., Lobo, E., García Teruel, D., Morales, V. et al. (2007). Manejo diagnóstico y terapéutico del insulinoma pancreático. Rev Española Enfermedades Dig, 99(4), 218-222.
- Castro Gomez, K. G., Contreras Romero, J. A., Afanador Jaimes, D. V., Álvarez Herrera, L. V., Gaitán Díaz, N. L., Saavedra López, H. F. (2024). Abordaje del insulinoma: revisión actualizada de la literatura. Rev Colomb Endocrinol Diabetes Metab, 15 de febrero.
- Schwermann, M. P. (2018). Diagnostic Evaluation of Insulinoma: A Case Report. Biomed J Sci Tech Res, 12(1).
- Santiago Pérez, A., Gutiérrez Santana, J., Santiago Pérez, A., Gutiérrez Santana, J. (2022). Insulinoma. Medicentro Electrónica, 26(4), 995-1001.
- Carrillo, D., Muñoz-Medel, M., Retamal, I., Pinto M., Bravo, M. L., Nervi, B. et al. (2021). Tumores Neuroendocrinos: un desafío transversal. Rev Médica Chile, 149(6), 888-898.
- Calderón, J. P. M., Marroquín, A. C. M., Chaves, G. S., Quesada, J. C. (2022). Insulinoma: Una visión general. Revista Ciencias Salud Integrando, 6(4), 106-110.
- Hernández, E., Corzo, G., González, M., García, F., Hernándes, L. de J., Oliveira-Gomes, D. D. et al. (2021). Tumores Neuroendocrinos Múltiples tipo Insulinoma cómo primera manifestación de múltiple tipo 1. Med Interna Venezuela, 37(1), 22-25.
- Figueroa, L. Á. C., Roca, A. J. (2022). Páncreas endocrino. Fisiología Endocrina, 96.
- Teixeira, D. de A. (2021). Fisiología humana. Teófilo Otoni UNIPAC, 36-43.
- Roca, A. J., Ardila, E. A., Figueroa, L. A. C. (2022). Fisiología endocrina. Editorial El Manual Moderno.
- Maggio, I., Mollica, V., Brighi, N., Lamberti, G., Manuzzi, L., Ricci, A. D. et al. (2020). The functioning side of the pancreas: a review on insulinomas. J Endocrinol Invest, 43(2), 139-148.
- Gil-Rivera, M., Medina-Gali, R. M., Martínez-Pinna, J., Soriano, S. (2021). Physiology of pancreatic β-cells: Ion channels and molecular mechanisms implicated in stimulus-secretion coupling. Int Rev Cell Mol Biol, 359, 287-323.
- Norton, L., Shannon, C., Gastaldelli, A., DeFronzo, R. A. (2021). Insulin: The master regulator of glucose metabolism. Metabolism, 129, 155142.
- Melmed, S., Auchus, R. J., Rosen, C. J. Williams (2021). Tratado de endocrinología. Elsevier Health Sciences.
- Revollo, Á. J. F., Miembro, M. I. E., Cartagena, E. (2015). Fisiología de la secreción de insulina y glucagón. Asoc Colomb Endocrinol.
- Krycer, J. R., Quek, L. E., Francis, D., Zadoorian, A., Weiss, F. C., Cooke, K. C. et al. (2020). Insulin signaling requires glucose to promote lipid anabolism in adipocytes. J Biol Chem, 295(38), 13250-66.
- Furió Novejarque, C. (2024). Contributions to Glucagon and Pramlintide Pharmacokinetics and Pharmacodynamics Modeling for Multi-Hormone Artificial Pancreas Systems. Universitat Politècnica de València.
- Rodríguez Palomo, D., Alfaro Benavides, A. (2010). Actualización de la fisiología gástrica. Med Leg Costa Rica, 27(2), 59-68.
- Roca, A. J. (2016). Anatomía y fisiología. Asociación Colombiana de Endocrinología, Diabetes y Metabolismo.
- Morales, A., Robles, G. (2008). El Páncreas. Fisiología. Revista Escuela Medicina “Dr José Sierra Flores”, 22(1), 17.
- Osaba, A. V. (2016). Papel fisiológico e implicaciones fisiopatológicas y terapéuticas de los sistemas somatostatina, cortistatina y sus receptores en el cáncer de mama y obesidad. Universidad de Córdoba (ESP).
- Chacón, J. C. (2011). Contribución de somatostatina, cortistatina, ghrelina y sus receptores a la regulación de la hormona del crecimiento en primates y roedores: implicación en condiciones metabólicas patofisiológicas. Universidad de Córdoba (ESP).
- Lumbreras Gavilanes, A. (2017). Somatostatina: bioquímica, fisiología y uso farmacológico.
- Velásquez, S., Velásquez, R., Leyton, M., Borjas, J., Custodio, Á. (2013). Modelado del control de la regulación de Glucosa. Univ Cienc Tecnol, 17(66), 11-18.
- Rojas, R. D. (2014). Control HSMC para regulación de glucosa sanguínea. Maskana, 5, 125-131.
- Salas, M. P. P., Peña, D. V., Núñez, K. F. C., Quirós, A. C. (2023). Neoplasia endocrina múltiple tipo 1: un abordaje práctico. Neoplasia.
- García, I. M., Tocino, R. V., García, E. M., Pérez, M. Á. M., Balbín, J. M. M. (2018). Síndromes de neoplasia endocrina múltiple: revisión radiológica. Rev Argent Radiol Argent J Radiol, 82(03), 124-130.
- Ramos-Rodríguez, M., Pasquali, L. (2024). Nuevas técnicas para el estudio de la genómica en la diabetes tipo.
- Hofland, J., Refardt, J. C., Feelders, R. A., Christ, E., de Herder, W. W. (2024). Approach to the patient: insulinoma. J Clin Endocrinol Metab, 109(4), 1109-1118.
- Marini, F., Giusti, F., Brandi, M. L. (2024). Genetic disorders and insulinoma/glucagonoma. Endocr Relat Cancer, 31(5).