Autores: Pedro Juan Lamboglia
Tutor del TFI: Dr. Fernando Hernandorena
Directora de tesis: Dra. Marta Luján Kura
Centro formador: Diagnóstico Científico Integral
Resumen
El cáncer es un problema de salud pública mundial. Con respecto al cáncer de recto, es un tumor que se ubica entre el margen anal y quince centímetros hacia proximal. Posee un alto índice de morbilidad y mortalidad y representa la cuarta causa de muerte a nivel mundial. En el mismo sentido, para el diagnóstico y estadificación del cáncer, la resonancia magnética se considera una técnica confiable. Sobre la base de lo anteriormente dicho, el presente documento tiene como objetivo reconocer la importancia de la aplicación de la resonancia magnética en los pacientes con cáncer de recto para obtener imágenes anatómicas que permitan establecer la estadificación del tumor. Se utilizó el método cualitativo para la descripción de la información obtenida.
Teniendo en cuenta las revisiones bibliográficas y la experiencia en el Sanatorio Franchin de la Ciudad Autónoma de Buenos Aires (CABA) se concluye que la RMN juega un papel determinante en el diagnóstico y tratamiento de cáncer de recto, debido a que mediante este método se colocan de manifiesto los hallazgos que determinarán la conducta a seguir por parte del médico tratante.
Palabras clave: cáncer, recto, resonancia, diagnóstico, estadificación.
Diagnóstico
Adriana Diéguez (2010), en su estudio, “Resonancia magnética de alta resolución en el cáncer de recto”, presenta la importancia de la resonancia magnética de alta resolución, que permite una adecuada identificación preoperatoria de importantes factores pronósticos de riesgo, mejorando la selección e indicación de la terapia para cada paciente. Además de esto, incluye el margen circunferencial de resección, la estadificación tumoral y ganglionar, la invasión vascular extramural y la descripción de tumores del recto inferior. Este estudio concluye que la capacidad de la resonancia magnética de alta resolución para demostrar con precisión la anatomía del mesorrecto ha convertido a este método en una herramienta útil en la estadificación del cáncer de recto. Permite identificar los factores pronósticos de riesgo que determinarán la elección del tratamiento adecuado para cada paciente.
La realización de un estudio técnicamente óptimo, que respete los parámetros de alta resolución, y la presencia de técnicos entrenados en su realización y de médicos radiólogos en la consola que supervisen el estudio son fundamentales para una adecuada interpretación de las imágenes. Es prioritario, asimismo, un informe detallado redactado por radiólogos dedicados y entrenados, que participen a su vez de grupos multidisciplinarios.(17)
Francisco José Crespo Villalba (2012), en su estudio “Estadificación del carcinoma de recto mediante resonancia magnética”, presenta la descripción de los aspectos anatómicos y patológicos de interés para la estadificación del carcinoma de recto. Además, muestra un protocolo de estudio adecuado para situar la masa tumoral y valorar su grado de infiltración mediante resonancia magnética, teniendo como referencia la clasificación TNM para el cáncer colorrectal. El mencionado estudio concluye que la imagen por RM es una técnica óptima para la estadificación del carcinoma de recto, la planificación de la cirugía y la reestadificación. El empleo de secuencias de alta resolución ponderadas en T2 es óptimo para tal propósito, ya que ofrecen un adecuado contraste entre las diferentes capas del recto y entre estas y el mesorrecto. La resonancia magnética resulta más adecuada que otras técnicas (ecografía, tomografía computarizada) para la valoración de las regiones y estructuras periféricas del recto, afectadas a menudo por la infiltración.(18)
Aluja Jaramillo y Upegui Jiménez (2016), en su estudio “Estadificación del cáncer colorrectal mediante resonancia magnética”, presentan la ventaja de la resonancia magnética en la estadificación del cáncer colorrectal. Además, resaltan que la ventaja de la resonancia magnética radica en la utilización de secuencias que permiten un adecuado contraste entre el tumor y los tejidos blandos circundantes, que no es posible mediante el uso de otras técnicas de imagen, como la tomografía axial computarizada. Este estudio concluye que la resonancia magnética es el método de elección para la valoración de la pelvis en los pacientes con cáncer colorrectal, ya que permite la predicción de márgenes de resección negativos, la determinación de metástasis a ganglios linfáticos, el compromiso de órganos adyacentes y con las nuevas secuencias incluso puede servir como predictor de respuesta al manejo de quimioterapia.(19)
Romero, Domínguez, Sánchez, Carmona y Pérez (2022), en su estudio “Utilidad de la resonancia magnética en la estadificación del cáncer de recto”, presentan el caso de un paciente masculino de 64 años de edad, con cambios en los hábitos intestinales y sin antecedentes importantes que acude para valoración de recto mediante resonancia magnética, donde se detecta tumor en recto medio T4aN1b. Dicho estudio concluye que la resonancia magnética rectal es una pieza clave en la estadificación local de los pacientes con cáncer de recto antes y después del tratamiento, proporciona información anatómica detallada que permite identificar factores de riesgo para el manejo, adaptar el tratamiento y mejorar el pronóstico.(20)
Introducción
Según López-Köstner et al. (2012), el cáncer rectal se define como el tumor ubicado entre el margen anal y los 15 cm hacia proximal.(1)
Cabe resaltar que el cáncer del recto posee un alto índice en su mortalidad y morbilidad, particularmente en la región occidental del planeta, de modo que su incidencia tiene un valor cercano al 30%.(2) De acuerdo con esto, representa la cuarta causa de muerte a nivel mundial.
Por otra parte, vale la pena mencionar que, para el análisis del estado de esta neoplasia, en 1986 se utilizó por primera vez la resonancia magnética,(3) a lo que se puede decir que con el transcurso de los años fue adquiriendo importancia y en la actualidad se considera como la prueba más idónea para efectuar la valoración de este tipo de cáncer.
Asimismo, como prueba diagnóstica imagenológica, la resonancia magnética tiene su fundamento en la observación de una variedad de planos, por medio de los que se determina la estadificación locorregional al conseguir la identificación de la neoplasia primaria y su nivel de infiltración sobre las diferentes capas musculares propias, las vísceras adyacentes a este y el tejido graso meso rectal.(4)
Por último, mediante las imágenes presentadas en esta investigación, los pacientes se pueden clasificar como candidatos a la radioterapia y/o a la quimioterapia previamente a la cirugía, además de coadyuvar en la planificación de esta.(5) De igual forma, es la técnica seleccionada aplicada a los pacientes a los que se les administró la radioterapia.(6)
Justificación
El cáncer es un problema de salud pública mundial, pues de acuerdo con la Organización Mundial de la Salud (OMS) corresponde a la causa número tres de fallecimientos, y la causa número dos de muerte en las naciones desarrolladas.(7)
En este sentido, la tasa de incidencia varía en todas las zonas del planeta, teniendo una tasa más elevada en los países de mayor desarrollo. Así, en el sexo masculino hay una variabilidad mayor, siendo las más altas las de Nueva Zelanda y Australia, ya que el cáncer afecta a 305 personas de cada 100,000. En seguida se encuentran Norteamérica, Europa occidental y el norte de Europa.(7)
Con respecto al cáncer de recto, es el cáncer que ocupa la cuarta posición en frecuencia entre los dos sexos, solamente por detrás del cáncer de mama, de próstata y de pulmón a nivel mundial. De igual forma, se ha estimado que este tipo de cáncer es la causa número cinco de fallecimientos en el mundo, incluyendo ambos sexos, solo por detrás del cáncer de pulmón, de mama, de hígado y de estómago.(8)
En el mismo sentido, para el diagnóstico y estadificación del cáncer, la resonancia magnética se considera como una técnica confiable, específica y reproducible hasta en un 92%, en particular para el pronóstico de los márgenes negativos de resección por medio del establecimiento de la correlación entre la neoplasia y el grado de infiltración sobre las distintas capas musculares propias.(9)
De este modo, mediante la resonancia magnética se ha podido establecer que es el agente de pronóstico más eficaz sobre la recurrencia locorregional de este tipo de cáncer es la distancia que existe entre el margen de resección y la neoplasia.(10)
La resonancia magnética se destaca entre las demás pruebas, en que emplea secuencias que hacen posible contrastar de forma apropiada el tejido blando adyacente y la neoplasia, lo cual no se puede realizar con las otras técnicas imagenológicas.(11)
Sobre la base de lo ya manifestado, en el presente documento se muestra la importancia que tiene la resonancia magnética para la detección del cáncer de recto. Es importante decir que esta técnica radiológica brinda una visión más clara del cáncer y resulta de gran importancia para la obtención de diagnósticos hacia este tipo de pacientes.
Objetivos
Objetivo general
Reconocer la importancia de la aplicación de la resonancia magnética en los pacientes con cáncer de recto para obtener imágenes anatómicas que permitan establecer la estadificación del tumor.
Objetivos específicos
- Analizar imágenes del recto por medio de la técnica de resonancia magnética.
- Resaltar la utilidad de las técnicas imagenológicas que permiten obtener mejor visibilidad en los pacientes con cáncer de recto.
- Elaborar la estadificación del cáncer de recto utilizando la valoración de las imágenes obtenidas de la resonancia magnética en pacientes con cáncer de recto.
Antecedentes
La mortalidad por cáncer a nivel mundial presenta un claro patrón ascendente, que también se refleja en el CCR. En el 2002, se registraron 12.684.189 defunciones por cáncer, de ellas, el 4,17% correspondieron a CCR, ubicándose dentro de las primeras diez causas de mortalidad por neoplasias malignas a nivel mundial. Asimismo, en relación con la magnitud de las tasas de incidencia por género, se observó que tanto la tasa global de incidencia (17,6 vs. 15,3 por 100.000 habitantes) como las tasas por grupo de edad son mayores en sexo masculino.(12)
Por su parte, el cáncer del recto posee una incidencia estimada en 40 de cada 100.000 personas en los países desarrollados,(2) y representa la tumoración maligna de mayor frecuencia del tracto gastrointestinal, ya que una tercera y hasta una cuarta parte de las neoplasias del colon y del recto son de carácter rectal. Además, tiene un elevado índice tanto de mortalidad como de morbilidad, y un pobre pronóstico ocasionado por el peligro de recurrencia locorregional posteriormente al procedimiento quirúrgico que oscila entre un 3% y hasta un 32%, así como de metástasis a distancia, con una tasa de sobrevivencia del 43% calculada a los cinco años.(13)
Ahora bien: se calculó que para el año 2015 habría 1,47 millones de nuevos casos de cáncer de recto, y que para el año 2030 este cáncer alcanzaría los 2,17 millones de nuevos casos, lo que causaría el fallecimiento de alrededor de 1,13 millones de pacientes.(14)
Asimismo, el pronóstico de los casos con cáncer rectal se encuentra asociado a diferentes factores, entre los que destacan:(15)
a) Infiltración de las venas extramurales.
b) Existencia de metástasis.
c) Alteración del margen o borde circunferencial de resección.
d) Cantidad de afectación de ganglios.
e) Extensión primaria de la infiltración neoplásica.
Por tales motivos, tanto la identificación de los factores de peligro como la estadificación locorregional son vitales para poder decidir el comportamiento terapéutico a implementar, siendo en este punto en donde cobran importancia los procedimientos imagenológicos. Así, la técnica más optimizada para la obtención de las imágenes es la resonancia magnética, puesto que posibilita la realización de una estadificación apropiada por medio de una elevada resolución espacial, pudiendo identificar la fascia mesorrectal y su correlación con la neoplasia.(16)
Debido a lo anterior, la resonancia magnética es el único procedimiento imagenológico que permite predecir el grado de afectación del margen o borde circunferencial de resección, teniendo una precisión bastante aceptable, además de que es la técnica que recoge la mayor cantidad de información sobre los factores pronósticos asociados a este tipo de tumoraciones.(15)
De acuerdo con lo anteriormente dicho, por medio de esta investigación se pretende demostrar que la resonancia magnética es la técnica de obtención de imágenes más apropiada para establecer la estadificación del cáncer rectal.
Marco teórico
El presente proyecto está basado en conceptos que se utilizan como base para esta investigación, que son los siguientes: recto, mesorrecto, cáncer de recto y la resonancia magnética, los cuales se describen a continuación.
Recto: es un tejido que tiene una longitud que va desde los 12 cm hasta los 15 cm, a partir de la unificación rectosigmoidea y finalizando en el margen del ano, dividiéndose en tres tercios o secciones con una longitud aproximada de 5 cm cada uno de estos, a saber: 1) tercio inferior, 2) tercio medio y 3) tercio superior.(2) Anatómicamente, el recto es el segmento terminal del tubo digestivo, desprovisto de meso y alojado en la concavidad del sacro, y que se extiende entre el asa sigmoide y el ano. El recto tiene esta protección peritoneal en su cara anterior hasta donde se originó el tabique de Retterer (mesénquima que escindió la cloaca) y en esa región hay una reflexión y el peritoneo pasa a recubrir la cara posterior del útero en la mujer y la cara posterior e inferior de la vejiga en el hombre.(21)
Mesorrecto: el recto es alojado en la excavación pelviana y en su cara posterior existe un rico plexo arterial, venoso y linfático que ocupa una capa de tejido grasoso circundado por una fascia, sin cobertura peritoneal. El límite superior del recto es la tercera vértebra sacra y coincide con el fin del mesocolon pelviano. En este punto el peritoneo se ensancha en forma de faldón sobre las caras laterales del recto y termina la formación de meso. Las dos hojas de serosa peritoneal del mesosigmoides se separan al alcanzar el recto y a medida que caminan abajo descubren cada vez más las caras laterales del recto y finalmente abandonan la cara anterior para reflejar lateralmente sobre las paredes pelvianas formando dos goteras longitudinales (divertículos pararrectales) y el fondo de saco de Douglas. La excavación pelviana o estrecho inferior se halla dividida en sentido anteroposterior por una sucesión de órganos envueltos por fascias que con ellos se disponen a la manera de un mediastino pelviano.(21)
Cáncer de recto: representa el 30% de los cánceres colorrectales, constituyendo una dificultad adicional en su manejo debido a su ubicación, cercanía con estructuras vecinas y eventual desmedro en la calidad de vida luego de su resección quirúrgica.(22) El cáncer rectal se define como el tumor ubicado entre el margen anal y los 15 cm hacia proximal. En el cáncer de recto, una precisa estadificación preoperatoria permite clasificar de forma correcta a los pacientes para las diversas terapias existentes, así como seleccionar el mejor tratamiento quirúrgico. La estadificación preoperatoria se realiza con el apoyo de métodos imagenológicos.(23) El pronóstico del cáncer de recto está relacionado de manera directa con la infiltración del tumor en el mesorrecto y la capacidad de lograr quirúrgicamente márgenes de resección circunferenciales negativos.(20)
Resonancia magnética: es un examen imagenológico en el que se usan imanes y ondas de radio potentes para poder observar diferentes imágenes del cuerpo, dependiendo de la zona que necesita de imágenes para confirmar o desechar un diagnóstico o sospecha de padecimiento de una enfermedad. La resonancia magnética rectal es la modalidad de imagen preferida para la estadificación local del cáncer de recto, ya que ayuda al radiólogo a describir la ubicación y la morfología del tumor, proporcionar sus categorías T y N, detectar la presencia de invasión vascular extramural, e identificar su relación con las estructuras circundantes, incluido el complejo de esfínteres y afectación de la fascia mesorrectal, además de la reestadificación después de la quimiorradioterapia neoadyuvante, es decir, la respuesta al tratamiento.(20)
La resonancia magnética nuclear ofrece algunas ventajas sobre otros métodos diagnósticos: comparada con el ultrasonido transrectal, permite mayor visualización de estructuras, depende menos del operador y, a diferencia del ultrasonido transrectal, permite valorar tumores estenóticos.(24)
Enfoque metodológico
La presente investigación se fundamenta en un enfoque cualitativo. Según Hernández- Sampieri (2018), el enfoque cualitativo se basa en métodos de recolección de datos sin medición numérica, como las descripciones y las observaciones. Por lo regular, las preguntas e hipótesis surgen como parte del proceso de investigación y este es flexible, y se mueve entre los eventos y su interpretación, entre las respuestas y el desarrollo de la teoría. Su propósito consiste en “reconstruir” la realidad, tal y como la observan los actores de un sistema social previamente definido.(25)
Diseño
Técnicas para la recolección de información
Las fuentes de información son todos aquellos medios de los que procede la información, que satisfacen las necesidades de conocimiento de una situación o problema presentado y que luego será utilizado para lograr los objetivos esperados.(26)
Las técnicas que se usaron en la presente investigación para recolectar la información fueron primeramente la observación, una fuente primaria y la revisión documental, que se considera una fuente secundaria por ser información sintetizada y reorganizada. Además de eso, también fueron consultadas varias plataformas privadas, que cuentan con casos clínicos pertinentes para la investigación.
Instrumentos de recolección de información
Los instrumentos usados para recolectar la información en esta investigación fueron el objetivo hacia la importancia de la resonancia magnética en el cáncer de recto, el cual direcciona hacia la búsqueda de la información y análisis de esta. Asimismo, las plataformas y revistas especializadas en este tipo de temas médicos.
Desarrollo
Anatomofisiología
El recto es un tejido que tiene una longitud que va desde los 12 cm hasta los 15 cm (centímetros), a partir de la unificación rectosigmoidea y finalizando en el margen del ano, dividiéndose en tres tercios o secciones con una longitud aproximada de 5 cm cada uno, a saber: 1) tercio inferior, 2) tercio medio y 3) tercio superior.(2)
De la observación y evaluación meticulosa de estos tres tercios depende la identificación y localización de la neoplasia y su posterior análisis y tratamiento. Además, la pared del recto está constituida por cuatro diferentes capas adyacentes y contiguas de conformación tisular distinta. La capa más interior se ha denominado como mucosa, y representa el límite directo con la luz rectal. Asimismo, de forma yuxtapuesta y sucesiva a la mucosa, se localizan las capas serosa, muscular y submucosa, teniendo la primera la posición más exterior.
No obstante, por medio de la resonancia magnética no se puede realizar la diferenciación entre la capa muscular y la capa serosa, por lo que se ha considerado como una parte más de la capa muscular. De este modo, la capa muscular es la que se considera como la capa más exterior, la cual se encuentra en contacto con el tejido graso mesorrectal, que es una estructura que circunda toda la longitud rectal, y que incluso es envuelto mediante una vaina tisular conectiva, a saber, la fascia mesorrectal.(27)
De igual modo, los vasos sanguíneos y los ganglios linfáticos pueden sufrir alteraciones al encontrarse en el interior de fascia mesorrectal, la cual se une por su parte delantera con el vestigio genitourinario, constituyendo el septo rectovaginal en el sexo femenino y la fascia de Denonvillier en el sexo masculino; asimismo, se correlaciona con la fascia de Waldeyer o fascia presacra parietal. A su vez, el peritoneo se incrusta rectalmente en la zona límite superior, que corresponde a la región transitoria con sigma.(27)
Por otra parte, en la resonancia magnética las capas rectales se observan a distintas intensidades de señal. Así, en las secuencias imagenográficas ponderadas del estadio 2 la capa de la submucosa se observa mediante una señal hiperintensa, mientras que los músculos y la mucosa se detectan con una señal hipointensa.
En este mismo sentido, el tejido graso mesorrectal se percibe como una señal hiperintensa, contrastando por completo con la imagen de los músculos, la cual facilita grandemente la identificación de posibles infiltraciones mesorrectales.(2, 27)
Estadificación
La estadificación es primordial para los pacientes con cáncer del recto, pues permite valorar tanto el pronóstico como planificar las distintas opciones de tratamiento terapéutico, ya que se deben tomar decisiones con respecto a si se utilizará la quimiorradioterapia prequirúrgica y/o el procedimiento operatorio, como la resección locorregional transanal o la resección anterior con la preservación o no del sistema esfinteriano; de la misma forma, se deben analizar de modo detallado los posibles eventos adversos, así como las funciones sexual y evacuatoria.
Lo anterior pone de manifiesto la importancia y lo esencial de efectuar una valoración óptima para poder establecer la estadificación prequirúrgica, que se modifica cuando el paciente se somete a la quimiorradioterapia prequirúrgica, puesto que se consigue disminuir de manera significativa la neoplasia en un porcentaje mayor al 70% de los casos, así como alcanzar una respuesta neoplásica total entre el 10% y el 20%.(28) De esta forma, la estadificación es directamente proporcional a la correlación con el grado de infiltración hacia los tejidos adyacentes y de la capa de músculos propia, así como de su ubicación.(11)
De modo que se ha establecido la siguiente clasificación, basada en TNM o Tumor, Adenopatía y Metástasis de la International Union Against Cancer y de la American Joint Committee on Cancer: (1, 27)
A) Tx, corresponde a una tumoración primaria que no se puede valorar.
B) T0, se refiere a que no existen evidencias de alguna tumoración primaria.
C) Tis, significa carcinoma in situ. Es una neoplasia ubicada en la mucosa, sin que exista infiltración
D) T1, se presenta cuando la neoplasia se infiltra en la capa de la submucosa.
E) T2, es cuando la neoplasia se infiltra en la capa muscular.
F) T3, se determina cuando la tumoración pasa a través de la capa muscular invadiendo los tejidos perirrectales. Adicionalmente, este estadio se puede clasificar de acuerdo con el nivel de infiltración en el tejido graso mesorrectal caracterizado por medio de las técnicas histopatológicas posquirúrgicas, de acuerdo en:
-pT3a: que corresponde a una expansión opcional,
-pT3b: cuando existe una invasión menor a un milímetro, por la parte exterior de la capa muscular,
-pT3c: cuando se presenta una invasión entre el rango de 1 mm a 5 mm, por el exterior de la capa muscular,
-pT3d: se refiere a una invasión mayor al rango de los 5 mm a los 15 mm, por la parte externa de la capa muscular.
G) T4, se presenta cuando la neoplasia pasa a través de la fascia mesorrectal y se infiltra en los tejidos y órganos pélvicos:
-T4a, cuando la tumoración altera la hoja peritoneal,
-T4b, cuando el tumor invade los tejidos y órganos intraperitoneales.
H) NX, se determina cuando los ganglios linfáticos no se pueden evaluar.
I) N0, es cuando en los ganglios linfáticos no existe metástasis.
J) N1, se presenta cuando la metástasis afecta de uno hasta tres ganglios linfáticos.
K) N2, se determina cuando la metástasis afecta a cuatro o más ganglios linfáticos.
L) MX, que se da al no poder establecer la presencia de metástasis a distancia.
M) M0, cuando se determina que no existe metástasis a distancia.
N) M1, corresponde a la presencia de metástasis a distancia.
Asimismo, también es de utilidad la estadificación de Dukes:(29, 30)
A) Estadio 0, donde T = Tis, N = N0 y M = M0.
B) Estadio I, en el que T = T1, N = N0, M = M0; y T = T2, N = N0 y M = M0.
C) Estadio IIA, en el cual, T = T3, N = N0 y M = M0.
D) Estadio IIB, en donde, T = T4, N = N0 y M = M0.
E) Estadio IIIA, en el que, T = T1, T2; N = N1 y M = M0.
F) Estadio IIIB, en el cual, T = T3, T4; N = N1 y M = M0.
G) Estadio IIIC, donde, T = Tis, T1, T2, T3, T4; N = N2 y M = M0.
H) Estadio IV, en el que, T = Tis, T1, T2, T3, T4; N = N0, N1, N2; y M = M1.
Existe otro tipo de clasificación, denominada R, en la que se puede observar tanto la ausencia como la presencia de neoplasias residuales de la tumoración primaria, a distancia y en los ganglios linfáticos, posteriormente al procedimiento quirúrgico, quimioterapéutico, radioterapéutico, o una combinación de estos. De modo que se puede obtener información sobre la eficacia del tratamiento, y del pronóstico, a saber:(31)
A) RX, que corresponde al estado en el que no es posible evaluar la existencia de una neoplasia residual.
B) R0, cuando no existe neoplasia residual.
C) R1, se presenta al identificar una neoplasia microscópica.
D) R2, se establece cuando se detecta la presencia de una tumoración residual macroscópica.
Además, en la estadificación locorregional, que incluye la evolución en la pared de la tumoración y el estado ganglionar perirrectal, no solo se evalúa el estado del margen circunferencial de resección. De esta manera, los pacientes que reciben quimiorradioterapia presentan una reducción significativa en la cantidad de ganglios, lo cual, aunado a la reincidencia y/o disminución de la tumoración completa, da como resultado una subestadificación.
En dicha subestadificación se usa el prefijo “y” para referirse al compromiso ganglionar y al grado de infiltración de la neoplasia en la pared. Empero, si se presenta un grupo de casos en los que posteriormente a la quimiorradioterapia no son sometidos a cirugía, se establecen las subestadificaciones siguientes:(28, 32)
A) Categorización clínica o cTNM.
B) Categorización patológica o posquirúrgica o pTNM.
C) Categorización posquimiorradioterapia neoadyuvante o yTNM.
D) Categorización posterapia neoadyuvante y procedimiento quirúrgico o ypTNM.
E) Categorización posrecidiva después de un período de tiempo sin el cáncer o rTNM.
Estadificación T
Los estudios imagenológicos son una excelente herramienta tanto para identificar neoplasias como para evaluar la extensión de esta por medio de la pared del recto. Asimismo, en la pared del recto, se identifican cinco láminas o capas, las cuales son enunciadas a continuación:(33)
1) La capa ecogénica, que concierne a la interfase presente entre la mucosa y el balón.
2) La lámina hipoecoica, que se refiere a la capa muscularis mucosa.
3) La lámina submucosa, que corresponde a la capa de mayor espesor refringente.
4) La lámina hipoecoica.
5) La capa muscular, que la limita el tejido graso del mesorrecto, es el músculo recto del abdomen, que se visualiza hiperecogénico en ultrasonido.
Ecografía endorrectal
En este sentido, el observar una banda ecogénica entre la lámina muscular y la neoplasia, correspondiendo a la capa de la submucosa preservada, dicha observación se convierte en un criterio de diagnóstico de cáncer en etapa T1. En cambio, cuando la tumoración se infiltra en la capa muscular difuminándose en el plano de la capa submucosa, esta observación corresponde a un diagnóstico de cáncer en etapa T2.(34)
En el caso de las neoplasias en etapa T3 y T4, en el primero, la masa hipoecoica pasa entre la lámina muscular y se infiltra en el tejido graso perirrectal; y en el segundo, la tumoración se difunde a los órganos adyacentes.(34)
Ahora bien: para la estadificación tipo T realizada por medio de la ecografía endorrectal, que es un procedimiento independiente del operador, tiene una precisión en el rango del 63% al 96%.(35, 36, 37, 38, 39, 40)
En este sentido, dos investigaciones que incluyeron más de 400 casos presentaron una precisión al diagnóstico de menos del 70%.(37, 38) Mientras que, en otro estudio, la precisión correspondió al 85%.(41) De igual forma, en otra investigación, que evaluó a 424 pacientes, la precisión correspondió al 81%.(40) Lo anterior muestra limitaciones de la ecografía endorrectal para establecer un diagnóstico apropiado.
La neoplasia es hipoecoica y generalmente hay presente un tejido de carácter fibroso o de un edema, que de igual forma son hipoecoicos, a su alrededor.
Resonancia magnética
Por otro lado, al efectuar la resonancia magnética, la lámina muscular propia y mucosa se observan mediante una señal hipointensa, en cambio, la lámina de la submucosa y del tejido graso del mesorrecto, tienen una señal hiperintensa.(27)
Asimismo, la capa exterior por lo general tiene interrupciones focales superficiales que corresponden a vasos que se infiltran en la pared del recto y que no se deben confundir con la neoplasia.
A su vez, la capa muscularis mucosa y la estructura bilaminar de la capa muscular propia, normalmente no son identificables en el procedimiento de la resonancia magnética.(27)
De igual manera, el cáncer del recto genera una señal menos intensa que la capa submucosa, pero una señalización mayor en comparación con la capa muscular; una excepción a esto se encuentra en las tumoraciones que presentan diferenciación mucinosa, que se desarrollan con variaciones en los niveles de hiperseñalización en las secuencias potencializadas en la etapa T2, pudiendo diferenciarse la etapa T1 de la etapa T2 por la falta de longitud tumoral en la lámina muscular.(42, 43)
Además, como determinados tipos de cáncer en etapa T1 entran en contacto con la lámina muscular, suavizan su contorno sin que haya infiltración, por lo cual el criterio utilizado en la valoración de una neoplasia en etapa T2 corresponderá a que la señal hipointensa parcial o total emitida por el grosor muscular sea reemplazada por la señalización de la neoplasia.(44, 45)
En la etapa T3 de cáncer del recto, el tejido graso perirrectal estará infiltrado y habrá un frente de la tumoración de forma nodular o redondeada, más alejada del contorno de la capa muscular. También, el contorno de la pared estará espiculado en la región tumoral, pero no será un criterio adecuado, ya que habitualmente dicha especulación se presenta debido a la fibrosis.(46, 47)
Ahora bien: la precisión diagnóstica de la resonancia magnética se ubica en un rango del 71% al 94%.(48,49) De hecho, el diagnóstico equivocado al utilizar esta técnica se atribuye a la problemática de distinguir una etapa T2 de una etapa T3.(50)
De manera general, la resonancia magnética es más sensible que la ecografía transrectal con respecto a la evaluación de las afectaciones nodales perirrectales, debido a que esta permite la identificación de los ganglios afectados por medio de otras características a parte de sus dimensiones.
Lo anterior es importante puesto que para emitir un diagnóstico se deposita mucha confianza en la dimensión de los ganglios, pues así se determina si estos son malignos o benignos.(51, 52, 53)
No obstante, existe una coincidencia bastante significativa entre los ganglios neoplásicos y los que son normales reactivos. Por ello, la capacidad para identificar las irregularidades y/o señales intranodales de los bordes hace más sensible a la resonancia magnética para detectar los ganglios linfáticos afectados.
En este sentido, la certeza preoperatoria de la resonancia magnética en la estadificación del cáncer rectal, respecto del grado de afectación de los ganglios, de la pared y del estado del margen circunferencial de resección, lo ejemplificó una evaluación histopatológica, como sigue:(54)
a) Afectación de los ganglios. Su especificidad correspondió al 71%, y su sensibilidad al 77%.
b) Estadificación T. Para T3/T4 contra T1/T2, la resonancia magnética tuvo una sensibilidad del 87%, mientras que la especificidad fue del 75%.
c) Estado del margen circunferencial de resección. Se obtuvo una especificidad del 94%, y una sensibilidad del 77%.
Igualmente, otras investigaciones han detectado que en las neoplasias de estado T3 que tienen un tamaño mayor a los 5 mm de infiltración extramural, poseen una sobrevivencia cáncer específica de un 54%, en comparación con el 85% que se presenta cuando existe una profundidad menor o igual a los 5 mm.(55)
Por ende, cuanto mayor sea el grado de infiltración de la neoplasia dentro del tejido graso perirrectal, mayor serán las afectaciones ganglionares, aunque las tumoraciones T3 que tienen una invasión superior a los 5 mm de profundidad, son consideradas como neoplasias de riesgo elevado.(56)
Asimismo, la eficiencia de la resonancia magnética preoperatoria en la evaluación de los pacientes que presentan una infiltración mayor a los 5 mm, se determinó en un ensayo clínico.(57)
Así, una evaluación se considera como de buen pronóstico cuando en la predicción de la seguridad en el estado del margen circunferencial de resección, el grado de infiltración es menor a los 5 mm en la capa muscularis, pero sin tomar en consideración el estado de los ganglios.
Vale la pena resaltar que, en el ensayo mencionado con anterioridad, de un total de 374 pacientes incluidos, solamente en 122 de los casos se pudo establecer un buen pronóstico hasta el estado T3 del cáncer, de modo que la sobrevivencia libre de progresión hasta los cinco años correspondió a un 85%, mientras que el ratio de la recidiva locorregional fue del 3%. De igual manera, en 57 casos se presentó un estado T2, N0, en los que solo en el 22% de los pacientes se detectaron ganglios positivos.
Finalmente, por medio de la anatomía patológica se identificaron cuatro pacientes que presentaron un estado del margen circunferencial de resección positivo, y mediante la resonancia magnética se identificaron ganglios positivos.(57)
Tomografía computarizada
Está técnica está limitada en la determinación de las etapas tempranas del cáncer debido a que no posee una adecuada resolución de contraste que permita diferenciar las láminas de la pared del recto, por lo cual la estadificación se fundamenta en el grado de infiltración de los órganos adyacentes y del tejido graso perirrectal, de modo que la especulación e irregularidad en la pared rectal son determinados como cáncer en etapa T3, mientras que la invasión de la neoplasia a los órganos adyacentes se determina como cáncer en etapa T4.(58)
Con respecto a su precisión de diagnóstico, en la actualidad se sitúa en un rango de entre el 86% y el 87%, pero utilizando la capacidad multiplanar del equipo, en contraposición al uso de las imágenes axiales solamente.(58, 59)
Debido a lo anterior, la resonancia magnética supera a la tomografía computarizada, ya que la primera tiene una elevada resolución de contraste, principalmente en la identificación de invasión en órganos como los intestinos, útero, próstata y vejiga.(60)
Estadificación N
En la ecografía endorrectal, los ganglios del mesorrecto se observan ecogénicos y con forma ovalada. A su vez, los ganglios heterogéneos o hipoecoicos que se visualizan de forma redonda o con bordes irregulares, se determinan como positivos.(34)
De este modo, la precisión de diagnóstico de dicha técnica se ubica en un rango de entre el 63% y el 86%, con referencia a la estadificación de los ganglios, y con un promedio correspondiente al 73%. Asimismo, si bien más del 50% de los ganglios con metástasis se ubican a una distancia menor a los 3 cm de la neoplasia principal, la ecografía endorrectal no es capaz de analizar a los ganglios que están por fuera del rango focal del transductor de señal, pero se les puede accesar por medio de la punción aspirativa.(61, 62)
Grado de infiltración
En la evaluación por medio de la resonancia magnética se considera como infiltrada cualquier capa de la pared del recto, sea cual sea el sitio en el que la intensidad de la señalización propia quede sustituida por la intensidad de la neoplasia.(63)
Debido a esto, se han descrito diferentes estadios de invasión de acuerdo con la alteración que presenten las distintas capas rectales, el mesorrecto y/o los órganos y tejidos pélvicos.
A este respecto, el significado del estadio 1 (T1) implica la alteración tanto de la submucosa como de la mucosa, empero no de la capa muscular, de modo que se mantiene la hipointensidad de señal en esta zona a través de toda la longitud del anillo del recto, lo que produce que la longitud de la tumoración esté delimitada por esta misma, pero sin infiltración.
En el caso del estadio 2 (T2), se presenta alterada la capa muscular, identificándose debido a que su hipointensidad de señal es sustituida por la de la neoplasia, empero la capa muscular mantiene su contorno sin que exista infiltración en el tejido graso mesorrectal.(63)
Para un estadio 3 (T3) la invasión neoplásica se produce más allá de los músculos propios, de modo que la tumoración puede observarse como un objeto nodular o redondeado. No obstante, la existencia de especulaciones no significa necesariamente que haya una infiltración, puesto que estas pueden ser ocasionadas por un proceso inflamatorio peritumoral o por una fibrosis.(63, 64)
A su vez, el estadio 4 (T4) ocurre cuando la neoplasia se ha infiltrado de forma extensa más allá de la fascia mesorrectal, de modo que altera la hoja peritoneal, otros tejidos de la pelvis y/o las vísceras intraperitoneales, denominando al primer caso como T4a y al último como T4b.(64)
Infiltración de los ganglios linfáticos
Mediante la resonancia magnética, los ganglios que están infiltrados emiten una señal hipointensa y/o heterogénea, con bordes irregulares, dos características que son las más representativas y que se utilizan como criterios de diagnóstico positivo a la infiltración.(65)
Además, un estudio permitió establecer que las dimensiones de los ganglios no se deben tomar como referencia patológica para considerar la presencia de cáncer, puesto que se observaron diversos ganglios benignos con un gran tamaño, así como ganglios con un diámetro menor a los 10 mm con metástasis. En este mismo sentido, otro estudio informó que alrededor del 30% de los ganglios infiltrados poseen diámetros menores a los 5 mm.(65, 66)
Ahora bien, en el caso de la hiperplasia linfoide benigna reactiva, se presenta un incremento del tamaño de los ganglios que bien pudiera resultar en un diagnóstico equivocado si no se siguieran los parámetros basados en la morfología, como son: bordes o contorno, heterogenicidad y la hipointensidad.(65, 67)
Por otra parte, para establecer el grado en que se ha infiltrado la neoplasia en los ganglios se toma en consideración la cantidad de los nódulos alterados y, de acuerdo con la clasificación ya mencionada TNM, si se logran identificar de uno a tres ganglios, el grado de infiltración corresponderá al estadio T1, mientras que si se identifican cuatro ganglios o más, el grado de infiltración será T2.(65, 67)
Ubicación de la neoplasia
De acuerdo con el nivel en el que se localice la extremidad distal de la neoplasia a partir del margen del ano, esta se pude denominar como de tercio inferior, ya que se encuentra a unos 5 cm del margen del ano; si la neoplasia se localiza a una longitud desde los 5,1 cm hasta los 10 cm, se denomina como de tercio medio; en el caso de que la tumoración se ubique desde los 10,1 cm hasta los 15 cm, se denomina tercio superior. Así se resalta la importancia de la reflexión peritoneal para poder localizar adecuadamente el límite del tercio superior rectal.(28)
Correlación entre la neoplasia y los tejidos adyacentes
Es de gran importancia tomar en consideración la interacción entre el tejido canceroso y los tejidos adyacentes, a saber: pared lateral pélvica, esfínter anal, órganos de la pelvis, reflexión peritoneal y fascia mesorrectal.(68, 69)
Pared lateral pélvica
Esta estructura reviste una gran importancia ya que tiene un íntimo contacto con el recto; además, también se pueden comprometer: el nervio sacro, el músculo obturador y periforme y el uréter, así como las venas y las arterias ilíacas comunes interna y externa. Incluso, a nivel del recto inferior y/o superior, que son regiones en las que no se pueden diferenciar sus capas, puede estar comprometida la pared lateral pélvica.(69)
Para realizar la valoración de este tejido se sugiere obtener imágenes de elevada resolución sagitales y coronales. Pero hay que considerar que la utilización de áreas de visión ampliadas conlleva una subestimación de la cercanía de la neoplasia con la pared lateral pélvica y, por lo tanto, se subestima el grado de compromiso estructural de esta.(69)
Compromiso linfático y vascular
La evaluación del cáncer rectal debe comprender tanto el grado de compromiso tisular adyacente como la estadificación neoplásica, así como la valoración de los ganglios linfáticos y los tejidos vasculares próximos.
Infiltración vascular
Si bien su infiltración carece de relevancia en el tratamiento, es esencial para determinar el pronóstico, por lo que se debe de evaluar por medio de estudios imagenológicos, sin olvidar que el crecimiento perivascular no se corresponde con el crecimiento intravascular.(68)
A este respecto, la localización de una neoplasia de gran tamaño en la luz tisular vascular, como en el caso de la vena y arteria media rectal y/o superior rectal, es determinante para establecer la infiltración del tumor.(70, 71) Además de lo anterior, se ha informado sobre el desarrollo de nódulos en el punto de crecimiento extramural, el incremento del tamaño de los vasos, heterogenicidad en la intensidad de señalización en la parte interna de los vasos, cercanía de la neoplasia a las arterias y/o venas pélvicas.(72, 68, 73)
Esfínter anal
Este tejido está conformado por el esfínter interior de músculo liso; esfínter externo del músculo estriado, que a su vez se compone por el elevador anal y una prolongación del músculo puborrectal; y por la continuación de la lámina circular rectal.(69)
Así, se debe de observar la ubicación del esfínter anal y la localización de la neoplasia por medio de estudios imagenológicos coronales, para poder determinar la asociación entre la tumoración con el límite superior muscular puborrectal, para que de esta manera se pueda establecer la posibilidad de efectuar una resección quirúrgica.(69)
Órganos de la pelvis
Los que con mayor frecuencia se comprometen por el cáncer del recto son: las vesículas seminales, la próstata, la vagina y el útero. Por ello, la evaluación de dichos tejidos, y de los nervios sacros y la fascia presacra, tienen relevancia para la planificación del procedimiento quirúrgico, particularmente debido a que cuando se compromete a cualquiera de los órganos mencionados la neoplasia se convierte en irresecable.(69)
Reflexión peritoneal
Este tejido se ubica en la porción superior de la vejiga hasta la porción anterior rectal, con lo que forma el saco recto-vesical. Cuando se observa por medio de imágenes de elevada resolución, en un estadio T2, se percibe una imagen hipointensa con forma de letra V, axialmente. Al estar comprometido este tejido, la neoplasia se estadifica como T4a.(69)
Fascia mesorrectal
Esta estructura es un sitio referente en sentido anatómico en la valoración diagnóstica de la prolongación neoplásica.(74, 75) De hecho, es el tejido de mayor importancia con respecto al pronóstico, puesto que su compromiso por parte de la tumoración incrementa el riesgo de reincidencia a distancia y local.(68)
Este tejido es la lámina visceral de la fascia interna de la pelvis, y conforma una unidad anatómica distinta cuando envuelve al recto, además contiene tejido graso mesorrectal, vasos linfáticos y ganglios. En los estudios imagenológicos con estadio T2 se observa como una imagen hipointensa adyacente al recto que se utiliza para planificar el procedimiento quirúrgico.(69)
Histológicamente, cuando hay una distancia superior al milímetro entre el límite de resección y la neoplasia, se asocia con una probabilidad más pequeña de reincidencia local.(69, 76) Por lo que, mientras sea menor la distancia, habrá una probabilidad mayor de que el tejido se comprometa.(68, 77)
La distancia se puede medir desde:(68, 69)
a) Un ganglio linfático con aspecto neoplásico.
b) Un trombo neoplásico interno de un tejido vascular.
c) Un depósito tumoral del mesorrecto.
d) El límite de la neoplasia a partir de su prolongación y más allá de su capa muscular propia.
Igualmente se debe tomar en consideración que, con la aplicación de un enema del recto, se produce una sobredistención rectal que puede hacer variar la distancia entre la fascia mesorrectal y la neoplasia, si bien no hay informes que establezcan su relevancia, sino que con la aplicación del enema se mejora la observación de daño tisular.(68, 78)
Estudios imagenológicos
Para poder tomar decisiones en cuanto al tratamiento a seguir respecto de un paciente cuyo diagnóstico es cáncer del recto se requiere: 1) la identificación de los factores que incrementen la gravedad del pronóstico, 2) obtener la correlación entre los tejidos adyacentes y la tumoración y 3) estadificar correctamente la enfermedad.(79, 80)
Además de la resonancia magnética, entre las técnicas utilizadas para detectar y estadificar el cáncer del recto se encuentran: la tomografía computarizada con emisión de positrones, la tomografía computarizada, la ecografía endorrectal o transrectal y el tacto rectal.(11,72)
Ecografía transrectal y endorrectal
Con referencia a la ecografía transrectal, para poder evaluar los 12 centímetros finales del recto, esta se puede efectuar por medio de una sonda flexible o rígida.(34) Asimismo, se utilizan transductores lineales y/o radiales con una frecuencia correspondiente a los 7 MHz, en la evaluación de la circunferencia rectal completa. En el caso de las punciones, se recomienda utilizar los transductores lineales, colocando en posición decúbito lateral izquierdo al paciente, una vez que se ha evacuado de manera espontánea o se ha inducido mediante un enema el contenido del recto. Por su parte, la ecografía endorrectal utiliza un endoscopio que ya tiene incorporada de frecuencia elevada.(81)
Tacto rectal
De igual forma se sugiere realizar el tacto rectal para ubicar con precisión la neoplasia, de modo que enseguida se pueda introducir la sonda de elección que se ha recubierto con un balón inflable que se distenderá con una solución acuosa. Se debe sobrepasar la neoplasia con la sonda e ir retirándola lentamente, manteniendo siempre un ángulo de 90 grados con respecto a la tumoración.(81)
Tomografía computarizada
Este conjunto de técnicas emplea la fase portal posteriormente a la administración intravenosa de un medio de contraste. En algunos casos el recto es distendido con solución acuosa o con metilcelulosa, y en otros casos el recto se evalúa sin que este se haya distendido.(51, 82, 83, 84, 85)
No obstante, en todos los casos, se debe disponer de un tomógrafo computarizado multidetector que permita la optimización de los resultados obtenidos, de modo que se las imágenes recolectadas correspondan a un rango de entre 2 mm y 5 mm de espesor en planos múltiples, incluso en los ángulos paralelos, oblicuos y perpendiculares con referencia al eje mayor de la neoplasia.
Además, la tumoración puede alterar parcial o totalmente la pared del recto, y las imágenes obtenidas axialmente con frecuencia esta se conforma a modo de una letra C.
También, la neoplasia infiltra la grasa de la parte central de la pared del recto, lo cual permite localizarlo como lateral, posterior o anterior.(51, 83)
Resonancia magnética
Para llevar a cabo este estudio no se requiere de una preparación previa por parte del paciente; sin embargo, limpiar el área mediante un enema unas pocas horas antes, asegura realizar la evaluación con el recto colapsado. Se sugiere no distender la luz intestinal, pues se podría comprimir el tejido graso mesorrectal, lo que reduciría la distancia observable entre la fascia mesorrectal y la neoplasia.(86)
Empero, la instilación por vía rectal de 50 ml (mililitros) de solución acuosa o de gel ecográfico no distiende de manera significativa el recto y coadyuva en la identificación óptima de la tumoración. De igual forma, se puede administrar un agente para paralizar el músculo liso previamente al procedimiento, como 20 mg (miligramos) de bromuro de escopolamina por vía intramuscular.(86, 87, 88)
Además, se requiere la utilización de bobinas phased array colocadas de manera apropiada en la pelvis, para asegurar una recepción de señal adecuada que alcance al periné desde el promontorio. Asimismo, la evaluación está conformada por secuencias fast T2 o turbo, por lo que no es necesaria la utilización de las secuencias potencializadas en T1, ni el uso de un medio de contraste paramagnético.
Con el estudio se deben de obtener imágenes axiales por encima de la pelvis y sagitales por encima del recto, y desde el promontorio hasta la parte inferior del periné de unos 5 mm de grosor, en un campo de visibilidad correspondiente a los 24 cm, de modo que se pueda localizar tanto la neoplasia como las potenciales adenopatías y su correlación con la fascia mesorrectal; esto coadyuvará en la prescripción de las secuencias de elevada resolución, que consisten en series potencializadas en T2 con unos 3 mm de grosor en un campo visual correspondiente a menos de 16 cm, que están prescritas por encima de la serie sagital.
Estas series deben de abarcar toda la tumoración y orientarse en el plano perpendicular con respecto al eje longitudinal del recto, pues son imprescindibles en la estadificación locorregional. De manera opcional se pueden prescribir imágenes de elevada resolución de la neoplasia, que estén en sentido paralelo al eje longitudinal del recto.
En las neoplasias del tercio inferior se requiere la obtención de imágenes de tipo coronal de elevada resolución que continúen sobre el eje mayor del canal anal.
Por su parte, la resonancia magnética endorrectal, aunque tiene una excelente resolución de contraste y de espacio en las regiones cercanas a la bobina, no se utiliza con tanta frecuencia, puesto que no es posible analizar apropiadamente el margen radial, y no puede realizarse en tumoraciones estenosantes, por lo que tiene una disponibilidad menor.(86, 87, 88)
Valoración de reincidencia
La reincidencia neoplásica se presenta en el 70% de los casos con respecto a los dos primeros años, y en el 85% con respecto a los tres años.(80, 81) En estos casos, la resonancia magnética posibilita la valoración de la infiltración del cáncer, y de igual modo el grado de compromiso en el que se encuentran los órganos y tejidos adyacentes,(80) teniendo una sensibilidad de entre el 80% y el 90%, así como una especificidad del 100%.(89, 91, 92, 93)
La reincidencia se puede clasificar de acuerdo con la ubicación y el grado de compromiso tisular en el plano axial en:(89, 94)
1) Anterior: cuando los tejidos involucrados son: las vesículas seminales, la próstata, la vejiga, la vagina y el útero.
2) Posterior: cuando los órganos implicados son: sacro, fascia presacra o coxis, los tejidos ubicados en la parte posterior del recto.
3) Lateral: si las estructuras afectadas son: los uréteres, los vasos iliacos y la pared lateral pélvica.
Hay que considerar además que se puede producir un incremento de la señal en secuencias con estado T2 que podrían hacer imperceptible la reincidencia neoplásica, en los casos de modificaciones inflamatorias provocadas por radioterapia neoadyuvante y/o radiación, hematomas residuales, granulación tisular y modificaciones posquirúrgicas.(89, 95) Dicho incremento de la señal puede permanecer hasta por dos años después de la cirugía.(89, 92)
Por lo anterior, la evaluación morfológica y el realce obtenido con el medio de contraste son dos factores de particular importancia que permiten diferenciar las modificaciones posquirúrgicas de una neoplasia reincidente o recidiva. Asimismo, la tumoración generalmente posee bordes redondeados, en contraste con la fibrosis, que produce bordes espiculados o angulares.(89)
Protocolo de la evaluación
Para obtener una visualización correcta del recto, se requiere de una previa limpieza de este, para que esté libre de cualquier materia y/o heces que puedan interferir en la observación; dicha limpieza la debe de efectuar el propio paciente en su domicilio, y si está hospitalizado, el enema lo realizará el personal del equipo de salud.(96)
Así, tal como se recomienda para el procedimiento de la resonancia magnética, se sugiere iniciar el procedimiento con una anamnesis y tomar todas las medidas que se necesiten para que no se presenten situaciones no deseadas debidas a válvulas, prótesis, objetos de metal o cualquier elemento que pueda afectar de modo negativo las imágenes y/o que puedan lesionar al paciente.
Después de lo anterior, se coloca al paciente en posición decúbito supino, manteniendo su respiración con suavidad durante el procedimiento, para que no sea necesaria la utilización de equipos de respiración.
Además, se recomienda usar una antena superficial ubicada en la pelvis, para asegurar una apropiada recepción de la señal que provendrá del promontorio del sacro y llegará al periné. Por otro lado, si bien el uso de una bobina endorrectal es eficaz para estadificar las neoplasias en un estado inicial, como en la infiltración de la capa de la submucosa- muscular, no se sugiere utilizarla pues no se desea producir una alteración en la luz rectal ni comprimir el tejido graso mesorrectal, lo cual pudiera producir una impresión equivocada con respecto a la distancia entre la fascia y la neoplasia, que es un factor determinante para abordar el procedimiento quirúrgico.(96) Igualmente, la utilización de las bobinas endorrectales es muy complicada, e incluso imposible, en los pacientes que presentan un proceso canceroso estenosante.(97)
Por otra parte, se sugiere utilizar secuencias diagnósticas “fast spin eco”, o FSE, de elevada resolución ponderadas en estado T2, ya que se requiere la obtención de una serie de imágenes que abarquen toda el área mesorrectal en los planos coronal y axial, así como de otra serie de imágenes ajustadas a la masa neoplásica.
No obstante, no se requiere la utilización de secuencias ponderadas de estado T1, así como de estado T1 con supresión del tejido graso, ni tampoco de secuencias STIR. De igual forma, no hace falta utilizar un medio de contraste paramagnético, ya que no contribuye con mejora alguna en la visualización de la neoplasia ni del nivel de infiltración.
Después del primer procedimiento de localización del tumor, se sugiere efectuar tres secuencias rápidas ponderadas en estado T2 “single shot” o de disparo único, en los tres planos, de modo que se obtenga una óptima visibilidad sobre la zona de exploración, así como una cercanía mayor a la región afectada. Inmediatamente se recomienda utilizar secuencias ponderadas de elevada resolución FSE de estado T2.
En primer lugar, se obtienen las imágenes correspondientes al plano sagital estricto que abarquen por completo el área del mesorrecto, y que también proporcionen datos para realizar el diagnóstico, es decir, de la prolongación cráneo-caudal de la neoplasia y del nivel de la infiltración; dichos datos permitirán realizar una planificación adecuada de las siguientes secuencias.
En segundo lugar, se obtendrán imágenes de los planos paralelo y perpendicular respecto del eje longitudinal rectal, que abarquen toda la zona mesorrectal, iniciando en el promontorio del sacro y culminando en el borde del ano, y desde el septo urogenital hasta el sacro.
La finalidad de todas las secuencias de imágenes es poder hacer la evaluación de potenciales adenopatías presentes en el mesorrecto, así como analizar la probabilidad de la aplicación de implantes.(87, 88)
Una vez realizado lo anterior, y de acuerdo con el tercio rectal en exploración, se requiere la obtención de los planos oblicuos de forma directa sobre la neoplasia, como se describe a continuación:(96, 97)
a) Tercio medio y superior del recto. Deben de obtenerse imágenes del plano axial oblicuo que abarquen la neoplasia completamente y que se oriente de forma perpendicular a su eje cráneo-caudal respecto del plano sagital. Con las imágenes obtenidas se evaluará tanto el tumor como el grado de afectación de la pared del recto y mesorrecto, al igual que de los órganos de la pelvis y sus estructuras.
b) Tercio inferior rectal. Se deben de obtener imágenes del plano oblicuo y coronal estricto de la adquisición sagital que permita relacionar al suelo de la pelvis y a los esfínteres con la neoplasia, o de esta con el canal del ano. Con estas imágenes se podrá planificar el procedimiento quirúrgico con la conservación de los esfínteres.
Asimismo, los factores de exploración para las secuencias de elevada resolución variarán solamente en el espesor de corte, que no debe ser más de 4 mm para las secuencias mesorrectales ni de menos de 3 mm para las secuencias particulares de la neoplasia.
Evaluación pronóstica con resonancia magnética
El procedimiento que aporta una gran cantidad de datos sobre los factores pronósticos del cáncer de recto es la resonancia magnética, ya que tiene una precisión muy alta en el análisis de la extensión extramural de la neoplasia.
Este valor corresponde a la medición obtenida del perímetro de la pared del recto y de la zona más distal de la infiltración, a través del tramo perpendicular hacia la tumoración. De modo que si la pared no es observable en la región de la infiltración se ha de ubicar la capa muscular en los bordes de la neoplasia y así trazar la condición esperada en el seno de la zona infiltrada.
Incluso, pueden encontrarse diferencias entre la medición realizada y la histológica en las tumoraciones ulceradas que reemplazan por completo a la región extendida de la pared de la capa muscular, aunque las imágenes que se hayan obtenido no sean perpendiculares a la neoplasia.(46)
En este sentido, un grupo de trabajo encontró una igualdad entre los descubrimientos patológicos de 0,5 mm y la resonancia magnética. Dicho estudio involucró un total de 295 pacientes.(99) Asimismo, esta igualdad es más precisa las tumoraciones T3 que se infiltran pobremente en el tejido adiposo en contraste con las tumoraciones más evolucionadas.(100)
De igual forma, en la evaluación de la infiltración de la fascia mesorrectal, la resonancia magnética es bastante eficiente y precisa, ya que presenta imágenes de una estructura hipointensa laminar que envuelve al tejido adiposo del mesorrecto.
No obstante, si la tumoración o los ganglios con infiltración se encuentran muy próximos a la fascia mesorrectal, y además entran en contacto entre sí y la sobrepasan, el borde de la resección radial se encontrará infiltrado. Para la evaluación anterior, se debe de considerar solamente al borde ubicado en la parte inferior de la reflexión peritoneal.
Pero si la tumoración solo se encuentra en la parte superior de la reflexión peritoneal, el borde de la resección se encontrará liberada, incluso si estuviera infiltrado el peritoneo. Por lo que siempre se debe de informar sobre la distancia que existe desde el borde radial hacia la tumoración, aunque no se presente la infiltración transmural del recto.
Asimismo, a las neoplasias que se encuentran anteriormente, así como las presentes en el tercio distal, se les asigna un peor pronóstico por causa de que en dichas regiones el tejido adiposo mesorrectal es escaso, y el recto se encuentra muy próximo a la fascia mesorrectal.
Es por ello que las tumoraciones en T2 localizadas en dichas zonas, y que también alteran el grosor de la pared del recto, si bien no se infiltran hacia el tejido adiposo perirrectal se pueden ubicar muy próximos a la fascia mesorrectal, por lo que generalmente poseerán un borde radial amenazado.
En este sentido, una investigación permitió demostrar que la resonancia magnética permitía hacer la identificación del margen liberado en la unidad de resección cuando la misma resonancia magnética observaba una tumoración con un tamaño de 5 mm o superior de la fascia mesorrectal.(44)
Por otro lado, una investigación que incluyó a 408 pacientes pudo establecer que la resonancia magnética tenía un 92% de especificidad en la detección del margen liberado, siempre que la neoplasia se encontrara a una distancia superior a 1 mm de la fascia mesorrectal.(101)
En otras palabras, si en determinado estudio se lee un margen o borde radial libre, no cabrá la posibilidad de una equivocación. Así, a una distancia superior a 1 mm o 2 mm la resonancia magnética conseguirá la identificación de un borde libre, lo que se usa con frecuencia en la literatura de medicina.(85)
Otro descubrimiento que hace posible la resonancia magnética es la infiltración de las venas extramurales. Esta normalmente se encuentra relacionada con el cáncer T3 o más, en el que el vaso de estudio debe de introducirse en la pared rectal en la región de la infiltración neoplásica.
Además, esta infiltración de las venas extramurales por lo general se acompaña de la expansión del vaso, por muy pequeña que esta sea. Por ello, este descubrimiento debe ser diagnosticado al observar una señal intensa intravascular intermedia, semejante a la de la tumoración, pero relacionado con un mínimo ensanchamiento del vaso.
Además, la confirmación del diagnóstico se complementará si el vaso en estudio se ha expandido con claridad y si su contorno es nodular. Con referencia a estos descubrimientos, la resonancia magnética posee un 62% y un 88% de sensibilidad y especificidad de forma respectiva.(73)
La identificación de la extensión de la tumoración hacia la zona superficial peritoneal, de estado T4b, se efectúa por medio de una infiltración de los nódulos anteriores a través de la reflexión peritoneal, que se detiene en la parte anterior rectal, o bien, por encima de esta.
Sin embargo, se pueden observar falsos negativos, puesto que se pueden desarrollar intersticios invaginados de peritoneo en la superficie peritoneal, que no son observables mediante la resolución espacial de la resonancia magnética, que se encuentren infiltradas por neoplasia, y que muestren una región superficial peritoneal libre en apariencia; del mismo modo se pueden obtener falsos positivos cuando se sospecha una infiltración en los pacientes en los que existe un frente de desarrollo neoplásico nodular que entra en contacto con el peritoneo, empero no lo infiltra.(46)
Histopatología
La región superficial de la capa mucosa del colon se encuentra horadada por una gran cantidad de oquedades denominadas como “criptas de Lieberkühn”, que tienen la superficie revestida por el epitelio cilíndrico. Además, el epitelio de la superficie se encuentra conformado esencialmente por tipos celulares cilíndricos y por determinados tipos celulares caliciformes.
A su vez, las criptas de Lieberkühn se encuentran revestidas esencialmente con especies celulares caliciformes, con excepción de su base, en la que se ubican unos cuantos grupos celulares no diferenciados, así como determinadas especies celulares de tipo neuroendocrinas.
Por su parte, las especies celulares basales indiferenciadas corresponden a la población de reserva celular de la capa mucosa colónica, las que a su vez han sufrido mitosis en numerosas ocasiones. Incluso, el colon está constituido por una capa de músculo interno circular y otra capa de músculo externo longitudinal.
En el caso de la pared colónica, esta se encuentra conformada por una lámina propia que engloba células linfocitarias, además de eosinófilos, fibroblastos, plasmocitos y macrófagos.
También, la capa del músculo mucoso engloba agregados de tipo linfoide, que se prolongan hasta la capa submucosa, que se encuentra constituida por células eosinófilas, mastocitos, macrófagos, células plasmáticas, linfocitos y tejido conjuntivo.
Así, los plexos nerviosos de Auerbach y de Meissner son los responsables de efectuar la inervación. De modo que el drenaje linfático es llevado a cabo mediante los vasos paracólicos linfáticos, que se encargan de drenar al grupo paraaórtico.(102)
Pólipos
Con anterioridad se realizó la propuesta de un modelo para la tumorogénesis que se denominó como de “Faeron y Vogelstein”, en el que se teorizaba sobre ciertas características de tipo genético que comparte el cáncer de recto con los adenomas, como lo son:(102)
1) La pérdida de los alelos en los cromosomas número 5 y 18.
2) La alteración genética presentada en el gen RAS.
En este modelo se indica que las modificaciones genotípicas acumuladas por la capa mucosa colorrectal producía la hiperplasia, que de manera progresiva se transformaba en un carcinoma invasor, carcinoma in situ y/o un adenoma.
De modo que las características de la neoplasia están determinadas tanto por las modificaciones genotípicas como por la acumulación de estas, y no así por su aparición cronológica.(103)
Por su parte, los pólipos pueden presentarse como hiperplásicos; hamartomas o no neoplásicos; y adenomas o adenomatosos, que son los más comunes y los que poseen un potencial más elevado de malignidad.
Asimismo, los adenomas, macroscópicamente, pueden observarse como sésiles o pediculados, que se caracterizan por ser los que evolucionan hacia la neoplasia. Estos se pueden presentar entre los 50 o 60 años.(104)
En este sentido, la probabilidad de que un adenoma evolucione malignamente es dependiente de las dimensiones del pólipo, de manera que:(102, 103, 104)
1) Si el tamaño es inferior a los 1,5 cm posee un índice muy reducido de malignizarse.
2) Si el tamaño se encuentra en un rango de entre 1,5 cm y 2,5 cm tiene un riesgo que oscila entre el 2% y el 10% de malignizarse.
3) Si tiene un tamaño por encima de los 2,5 cm se le asigna un índice superior al 10% de probabilidad de volverse maligno.
De igual forma, los pólipos papilares o más vellosos son los que con mayor frecuencia evolucionan a malignidad, y corresponden a un 5% del total de adenomas, mientras que los túbulo vellosos o tubulares son menos propensos a malignizarse.
Por otra parte, una vez que se ha desarrollado la malignidad, la neoplasia presenta tres niveles de diferenciación, que son dependientes de la secreción mucosa del patrón predominante, del pleomorfismo de las células y de la estructura de las glándulas:
1) Pobre.
2) Moderado.
3) Intensificado.
Así, se pueden mencionar los siguientes tipos histológicos de carcinomas:(102, 103, 104)
a) No diferenciado. La estructura glandular se encuentra conservada en un 50%.
b) Adenoescamoso. Aunque se presenta infrecuentemente, se caracteriza porque sus componentes glandulares y escamosos poseen malignidad hasta el grado de provocar metástasis.
c) De células en anillo de sello. Permanece al interior de las células y presiona hacia fuera al núcleo, es un carcinoma que produce mucina.
d) Neuroendocrino. Se han identificado dos subtipos, a saber: con células de tamaño pequeño y con células de tamaño grande.
e) Coloide o mucinoso. Se caracteriza por excretar mucosidad y crecer discohesivamente, invadiendo el espacio intersticial que generan lagunas coloides y mucosas.
f) Medular. Está diferenciado de manera pobre, es sólido predominantemente y presenta invasión linfocitaria intratumoral.
g) De células escamosas. Lo conforman grupos celulares escamosos atípicos, que se correlacionan con un proceso infeccioso por el Virus del Papiloma Humano. Es ubicuo principalmente del canal anal. Tiene una elevada tasa de metástasis ganglionar.
h) Adenocarcinoma. Se origina en el epitelio glandular de la capa mucosa colorrectal. Está conformado por grupos celulares malignos.
i) Confinado a la capa mucosa o in situ.
j) Otros. Como los tumores carcinoides, los linfomas y el sarcoma de Kaposi.
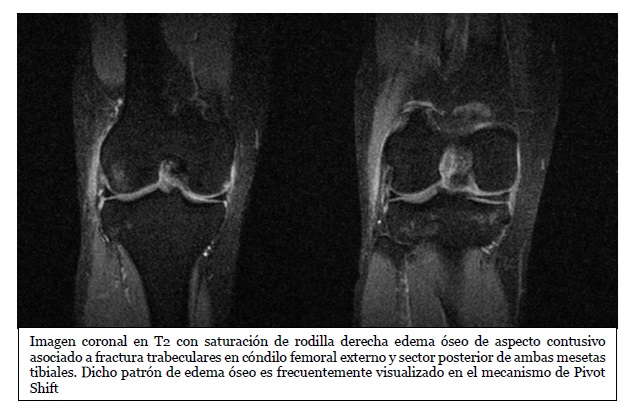
Imágenes de resonancia magnética
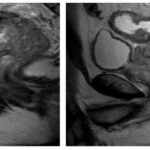
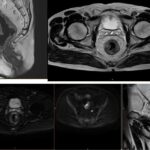

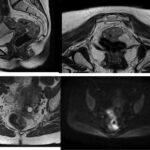

Conclusiones y recomendaciones
Teniendo en cuenta las revisiones bibliográficas y la experiencia en el Sanatorio Franchin se concluye que la RMN juega un papel determinante en el diagnóstico y tratamiento de cáncer de recto, debido a que mediante este método se coloca de manifiesto los hallazgos que determinaran la conducta a seguir por parte del médico tratante de acuerdo a las manifestaciones imagenológicas evidenciadas mediante el estudio, ya sea la infiltración, invasión, tamaño del tumor, lo cual podrá categorizara al paciente y determinar así un tratamiento adecuado según sea el caso. Hay otros métodos imagenológicos que también evalúan la patología tales como la ecografía y tomografía con porcentaje de sensibilidad menor a la RMN. Debido a las diferentes secuencias y dinamismo que maneja RMN este método Es así un importante complemento en el diagnóstico, tratamiento y manejo del cáncer rectal.
Referencias bibliográficas
- López-Köstner, Francisco, Carrillo G, Katya, Zárate C, Alejandro, Brien S, Andrés O, & Ladrón de Guevara H, David. (2012). Cáncer de recto: diagnóstico, estudio y estadificación. Revista chilena de cirugía, 64 (2), 199-209. https://dx.doi.org/10.4067/S0718- 40262012000200016https://scielo.conicyt.cl/pdf/rmc/v146n2/0034-9887-rmc- 146-02-0196.pdf.2.
- Ayuso Colella JR, Pagés Llinás M, Ayuso Colella C. Estadificación del cáncer de recto. Radiología. 2010. 52:18-29.
- Muthusamy VR, Chang KJ. Optimal methods for staging rectal cancer. Clin Cancer Res. 2007. 13 (22):6877s-6884s.
- Beets-Tan RGH, Beets GL. Rectal cancer: how accurate can imaging predict the T stage and the circumferential resection margin. Int J Colorectal Dis. 2003. 18(5):385-391.
- Kaur H, Choi H, You YN, Rauch GM, Jensen CT, Hou P, et al. MR imaging for preoperative evaluation of primary rectal cancer: practical considerations. Radiographics. 2012. 32(2):389-409.
- Kwok H, Bissett IP, Hill GL. Preoperative staging of rectal cancer. Int J Colorectal Dis. 2000. 15:9-20.
- World Health Organization. The World Health Report 2003-Shaping the future. Geneva, Switzerland: World Health Organization; 2003.
- Marzo-Castillejo M, Bartolomé-Moreno C, Bellas-Beceiro B, Melús-Palazón E, Vela-Vallespín C. Recomendaciones de Prevención del Cáncer. Actualización PAPPS 2022 [PAPPS Expert Groups. Cancer prevention recommendations: Update 2022]. Aten Primaria. 2022 Oct;54 Suppl 1(Suppl 1):102440. Spanish. doi: 10.1016/j.aprim.2022.102440. PMID: 36435580; PMCID: PMC9705215.
- Beets-Tan RGH, Beets GL. Rectal cancer: how accurate can imaging predict the T stage and the circumferential resection margin. Int J Colorectal Dis. 2003. 18(5):385-391.
- Beets-Tan RGH, Beets GL. Rectal cancer: review with emphasis on MR imaging. Radiology. 2004. 232(2):335-346.
- Torkzad MR, Pahlman L, Glimelius B. Magnetic resonance imaging (MRI) in rectal cancer: a comprehensive review. Insights Imaging. 2010. 1(4):245-267.
- Tirado-Gómez, L. L., & Mohar-Betancourt, A. (2008). Epidemiología del cáncer de colon y recto. Gaceta Sociedad Española de Oncología Médica, 7 (S4), 3-11.
- Iafrate F, Laghi A, Paolantonio P, Rengo M, Mercantini P, Ferri M et al. Preoperative staging of rectal cancer with MR Imaging: correlation with surgical and histopathologic findings. Radiographics. 2006. 26:701-714.
- World Health Organization. The World Health Report 2003-Shaping the future. Geneva, Switzerland: World Health Organization; 2003.
- McMahon CJ, Smith MP. Magnetic resonance imaging in locoregional staging of rectal adenocarcinoma. Semin Ultrasound CT MR. 2008. 29:433-453
- Ho ML, Liu J, Narra V. Magnetic resonance imaging of rectal cancer. Clin Colon Rectal Surg. 2008. 21:178-187.
- Dieguez, A. (2009). Resonancia magnética de alta resolución en la estadificación del cáncer de recto. Rev. argent. resid. cir, 12-21.
- Villalba, F. J. C. (2012). Estadificación del carcinoma de recto mediante resonancia magnética. Imagen Diagnóstica, 3(2), 56-62.
- Aluja Jaramillo, F., & Upegui Jiménez, D. (2016). Estadificación del cáncer colorrectal mediante resonancia magnética. Revista colombiana de Gastroenterología, 31(3), 273-282.
- Romero, E. M., Domínguez, S. A., Sánchez, M. D. J. D., Carmona, X. I., & Pérez, M. D. G. G. (2022). Utilidad de la resonancia magnética en la estadificación del cáncer de recto. Acta médica Grupo Ángeles, 20(3), 275-277.
- Dos Reis Neto, J. A., & dos Reis Junior, J. A. (2009). Anatomía quirúrgica del recto: Su importancia. Revista Mexicana de Coloproctología Enfermedades del Ano, Recto y Colon, 15(3), 65-70.
- Deichler, F., Fernández, P., Santana, G., Fonfach, C., Avendaño, R., Murua, A., & Torrijos, C. (2006). Cáncer de recto. Cuadernos de Cirugía, 20(1), 28-35.
- Lôpez-Kôstner, F., Carrillo, K., Zárate, A., Brien, A. O., & Ladrón de Guevara, D. (2012). Cáncer de recto: diagnóstico, estudio y estadificación. Revista chilena de cirugía, 64(2), 199-209.
- Decanini-Terán, C. Ó., González-Acosta, J., Obregón-Méndez, J., & Vega-de Jesús, M. (2011). Cáncer de recto. Diagnóstico, estadificación y tratamiento. Cirugía y Cirujanos, 79(5), 481-487.
- Hernández Sampieri, R., Fernández Collado, C., & Baptista Lucio, P. (2018). Metodología de la investigación (Vol. 4, pp. 310-386). México: McGraw-Hill Interamericana.
- Soberón, U. E. M., & Acosta, Z. (2009). Fuentes de información para la recolección de información cuantitativa y cualitativa. Obtenido de https://docs. bvsalud. org/biblioreJ/2018/06/885032/texto-no-2-fuentes-deinformacion. pdf.
- Brown J, Kirkham A, Williams GT, Bourne M, Radcliffe AG, Sayman J, et al. High-resolution MRI of the anatomy important in total mesorectal excision of the rectum. AJR Am J Roentgenol. 2004. 182:431-9.
- Latkauskas T, Paskauskas S, Dambrauskas Z, Gudai-tyte J, Saladzinskas S, Tamelis A, et al. Preoperative chemoradiation vs radiation alone for stage II and III resectable rectal cancer: a meta-analysis. Colorectal Dis. 2010. 12:1075-83.
- Van Cutsem E, Dicato M, Haustermans K, Arber N, Bosset JF, Cunningham D, et al. The diagnosis and management of rectal cancer: Expert discussion and recommendations derived from the 9th World Congress on Gastrointestinal Cancer, Barcelona, 2007. Ann Oncol. 2008.19(Suppl6):vi1-8.
- Compton CC, Greene FL. The staging of colorectal cancer: 2004 and beyond. CA Cancer J Clin. 2004. 54:295-308.
- Wittekind C, Compton CC, Greene FL, Sobin LH. TNM residual tumor classification revisited. Cancer. 2002. 94:2511-6.
- American Joint Committee on Cancer. AJCC Cancer Staging Manual. 7th edition, Edge, SB, Byrd, DR, Compton, CC, et al. Springer-Verlag, New York. 2010. p.143.
- Maier AG, Barton PP, Neuhold NR, Herbst F, Teleky BK, Lechner GL. Peritumoral tissue reaction at transrectal US as a posible cause of over staging in rectal cancer: Histopathologic correlation. Radiology. 1997. 203:785-9.
- Goh V, Halligan S, Bartram CI. Local radiological staging of rectal cancer. Clin Radiol. 2004. 59:215-26.
- Jochem RJ, Reading CC, Dozois RR, Carpenter HA, Wolff BG, Charboneau JW. Endorectal ultrasonographic staging of rectal carcinoma. Mayo Clin Proc. 1990. 65:1571-7.
- Akasu T, Kondo H, Moriya Y, Sugihara K, Gotoda T, Fujita S, et al. Endorectal ultrasonography and treatment of early stage rectal cancer. World J Surg. 2000. 24:1061-8.
- García-Aguilar J, Pollack J, Lee SH, Hernández DA, Mellgren A, Wong WD, et al. Accuracy of endorrectal ultrasonography in preoperative staging of rectal tumors. Dis Colon Rectum. 2002. 45:10-5.
- Marusch F, Koch A, Schmidt U, Zippe lR, Kuhn R, Wolff S, et al. Routine use of transrectal ultrasound in rectal carcinoma: Results of a prospective multicenter study. Endoscopy. 2002. 34:385-90.
- Mackay SG, Pager CK, Joseph D, Stewart PJ, Solomon MJ. Assessment of the accuracy of transrectal ultrasonography in anorectal neoplasia. Br J Surg. 2003. 90:346-50.
- Knaebel HP, Koch M, Feise T, Benner A, Kienle P. Diagnostics of rectal cancer: Endorectal ultrasound. Recent Results Cancer Res. 2005. 165:46-57.
- Harewood GC. Assessment of publication bias in the reporting of EUS performance in staging rectal cancer. Am J Gastroenterol. 2005. 100:808-16.
- Kachnic LA, Hong TS, Ryan DP. Rectal cancer at the crossroads: The dilemma of clinically staged T3, N0, M0 disease. J Clin Oncol. 2008. 26:350-1.
- Brown G, Richards CJ, Newcombe RG, Dallimore NS, Radcliffe AG, Carey DP, et al. Rectal carcinoma: Thin-section MR imaging for staging in 28 patients. Radiology. 1999. 211:215-22.
- Beets-Tan RG, Beets GL, Vliegen RF, Kessels AG, Van-Boven H, De Bruine A, et al. Accuracy of magnetic resonance imaging in prediction of tumour-free resection margin in rectal cancer surgery. Lancet. 2001. 357:497-504.
- Gagliardi G, Bayar S, Smith R, Salem RR. Preoperative staging of rectal cancer using magnetic resonance imaging with external phase-arrayed coils. Arch Surg. 2002. 137:447-51.
- Brown G, Radcliffe AG, Newcombe RG, Dallimore NS, Bourne MW, Williams GT. Preoperative assessment of prognostic factors in rectal cancer using highresolution magnetic resonance imaging. Br J Surg. 2003. 90:355-64.
- Bianchi PP, Ceriani C, Rottoli M, Torzilli G, Pompili G, Malesci A, et al. Endoscopic ultrasonography and magnetic resonance in preoperative staging of rectal cancer: Comparison with histologic findings. J Gastrointest Surg. 2005. 9:1222-7.
- Ferri M, Laghi A, Mingazzini P, lafrate F, Meli L, Ricci F, et al. Preoperative assessment of extramural invasion and sphincteral involvement in rectal cancer by magnetic resonance imaging with phased-array coil. Colorectal Dis. 2005. 7:387-93.
- Akasu T, Iinuma G, Fujita T, Muramatsu Y, Tateishi U, Miyakawa K, et al. Thin section MRI with a phased-array coil for preoperative evaluation of pelvic anatomy and tumor extent in patients with rectal cancer. AJR Am J Roentgenol. 2005. 184:531-8.
- Beets-Tan RG, Beets GL. Rectal cancer: Review with emphasis on MR imaging. Radiology. 2004. 232:335-46.
- Gualdi GF, Casciani E, Guadalaxara A, et al. Local staging of rectal cancer with transrectal ultrasound and endorectal magnetic resonance imaging: comparison with histologic findings. Dis Colon Rectum. 2000. 43:338.
- Brown G, Richards CJ, Bourne MW, et al. Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology. 2003. 227:371
- Blomqvist L, Machado M, Rubio C, et al. Rectal tumour staging: MR imaging using pelvic phased-array and endorectal coils vs endoscopic ultrasonography. Eur Radiol. 2000. 10:653.
- Al-Sukhni E, Milot L, Fruitman M, et al. Diagnostic accuracy of MRI for assessment of T category, lymph node metastases, and circumferential resection margin involvement in patients with rectal cancer: a systematic review and meta-analysis. Ann Surg Oncol. 2012. 19:2212.
- Shin R, Jeong SY, Yoo HY, et al. Depth of mesorectal extension has prognostic significance in patients with T3 rectal cancer. Dis Colon Rectum. 2012. 55:1220.
- Evans J, Patel U, Brown G. Rectal cancer: primary staging and assessment after chemoradiotherapy. Semin Radiat Oncol. 2011. 21:169.
- Taylor FG, Quirke P, Heald RJ, et al. Preoperative high-resolution magnetic resonance imaging can identify good prognosis stage I, II, and III rectal cancer best managed by surgery alone: a prospective, multicenter, European study. Ann Surg. 2011. 253:711.
- Kulinna C, Scheidler J, Strauss T, Bonel H, Herrmann K, Aust D, et al. Local staging of rectal cancer: Assessment with double-contrast multislice computed tomography and transrectal ultrasound. J Comput Assist Tomogr. 2004. 28:12330.
- Sinha R, Verma R, Rajesh A, Richards CJ. Diagnostic value of multidetector row CT in rectal cancer staging: Comparison of multiplanar and axial images with histopathology. Clin Radiol. 2006. 61:924-31.
- Blomqvist L, Holm T, Nyren S, Svanstrom R, Ulvskog Y, Iselius L. MR imaging and computed tomography in patients with rectal tumours clinically judged as locally advanced. Clin Radiol. 2002. 57:211-8.
- Le Blanc JK. Imaging and management of rectal cancer. Nat Clin Pract Gastroenterol Hepatol. 2007.4:665-76.
- Skandarajah AR, Tjandra JJ. Preoperative loco-regional imaging in rectal cancer. ANZ J Surg. 2006. 76:497-504.
- Brown G, Richards C, Newcombe RG, Dallimore NS, Radcliffe AG, Carey DP, et al. Rectal carcinoma: thin section MR imaging for staging in 28 pacients. Radiology. 1999. 211:215-22.
- Beets-Tan RG, Beets GL. Rectal cancer: review with emphasis on MR imaging. Radiology. 2004. 232:335-46.
- Brown G, Richards K, Bourne M, Newcombe R, Radcliffe A, Dallimore N, et al. Morphologic predictors of lymph node status in rectal cancer with use of high-spatial-resolution MR imaging with histopathologic comparison. Radiology. 2003. 227:371-7.
- Iyer Revathy B, Silverman PM, DuBrow RA, Charnsangavej C. Imaging in the diagnosis, staging, and follow up of colorectal cancer. AJR Am J Roentgenol. 2002. 179:3-13.
- Koh DM, MacVicar D. MRI of the pelvis. En: Reimer P, Parizel PM, Meaney JFM, Stichnoth FA, editores. Practical MR imaging. A practical approach. 3rd. ed. Berlin: Springer Verlag. 2010. 472-475.
- Torkzad MR, Pahlman L, Glimelius B. Magnetic resonance imaging (MRI) in rectal cancer: a comprehensive review. Insights Imaging. 2010. 1(4):245-267.
- Kaur H, Choi H, You YN, Rauch GM, Jensen CT, Hou P, et al. MR imaging for preoperative evaluation of primary rectal cancer: practical considerations. Radiographics. 2012. 32(2):389-409.
- Brown G, Richards CJ, Newcombe RG, Dallimore NS, Radcliffe AG, Carey DP, et al. Rectal carcinoma: thin-section MR imaging for staging in 28 patients. Radiology. 1999. 211(1):215-222.
- Smith NJ, Barbachano Y, Norman AR, Swift RI, Abulafi AM, Brown G. Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer. Br J Surg. 2008. 95(2):229-236.
- Matsuoka H, Masaki T, Sugiyama M, Nakamura A, Takahara T, Hachiya J, Atomi Y. Gadolinium enhanced endorectal coil and air enema magnetic resonance imaging as a useful tool in the preoperative examination of patients with rectal carcinoma. Hepatogastroenterology. 2004. 51(55):131-135.
- Smith NJ, Shihab O, Arnaout A, Swift RI, Brown G. MRI for detection of extramural vascular invasion in rectal cancer. AJR Am J Roentgenol. 2008. 191(5):1517-1522.
- Klessen C, Rogalla P, Taupitz M. Local staging of rectal cancer: the current role of MRI. Eur Radiol. 2007. 17(2):379-389.
- Bisset IP, Chau KY, Hill GL. Extrafascial excision of the rectum: surgical anatomy of the fascia propria. Dis Colon Rectum. 2000. 43(7):903-910.
- Quirke P, Durdey P, Dixon MF, Williams NS. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection: histopathological study of lateral tumour spread and surgical excision. Lancet. 1986. 2(8514):996-999.
- Mathur P, Smith JJ, Ramsey C, Owen M, Thorpe A, Karim S, Burke C, Ramesh S, Dawson PM. Comparison of CT and MRI in the pre-operative staging of rectal adenocarcinoma and prediction of circumferential resection margin involvement by MRI. Colorectal Dis. 2003. 5(5):396-401.
- Slater A, Halligan S, Taylor SA, Marshall M, Distance between the rectal wall and mesorectal fascia measured by MRI: effect of rectal distension and implications for preoperative prediction of a tumour-free circumferential resection margin. Clin Radiol. 2006. 61(1):65-70.
- Van-Cutsem E, Dicato M, Haustermans K, Arber N, Bosset JF, Cunningham D, et al. The diagnosis and management of rectal cancer: Expert discussion and recommendations derived from the 9th World Congress on Gastrointestinal Cancer, Barcelona, 2007. Ann Oncol. 2008. 19(Suppl6):vi1-8.
- Glimelius B, Oliveira J. Rectal cancer: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol. 2008. 19:ii31-2.
- Fusaroli P, Caletti G. Endoscopic ultrasonography: Current clinical role. Eur J Gastroenterol Hepatol. 2005. 17:293-301.
- Palko A, Gyulai C, Fedinecz N, Balogh A, Nagy F. Water enema CT examination of rectum cancer by reduced amount of water. Rofo. 2000. 172:901-4.
- Kulinna C, Eibel R, Matzek W, Bonel H, Aust D, Strauss T, et al. Staging of rectal cancer: Diagnostic potential of multiplanar reconstructions with MDCT. AJR Am J Roentgenol. 2004. 183: 421-7.
- Taylor A, Slater A, Mapstone N, Taylor S, Halligan S. Staging rectal cancer: MRI compared to MDCT. Abdom Imaging. 2007. 32:323-7.
- Ayuso JR, Ayuso C, Pagés M, De Juan C, Delgado S, Balaguer F. Estudio comparativo entre RM y TCMD de la precisión diagnóstica preoperatoria en la infiltración del margen radial en el cáncer de recto. Datos preliminares. Radiología. 2008. 50(Suppl2):35.
- Slater A, Halligan S, Taylor SA, Marshall M. Distance between the rectal wall and mesorrectal fascia measured by MRI: Effect of rectal distension and implications for preoperative prediction of a tumour-free circumferential resection margin. Clin Radiol. 2006. 61:65-70.
- Brown G, Daniels IR, Richardson C, Revell P, Peppercorn D, Bourne M. Techniques and trouble-shooting in high spatial resolution thin slice MRI for rectal cancer. Br J Radiol. 2005. 78:245-51.
- Taylor FG, Swift RI, Blomqvist L, Brown G. Asystematic approach to the interpretation of preoperative staging MRI for rectal cancer. AJR Am J Roentgenol. 2008. 191:1827-35.
- Sinaiei M, Swallow C, Milot L, Moghaddam PA, Smith A, Atri M, et al. Patterns and Signal Intensity Characteristics of Pelvic Recurrence of Rectal Cancer at MR Imaging. Radiographics. 2003. 33(5):E171-E187.
- Palmer G, Martling A, Cedermark B, Holm T. A population-based study on the management and outcome in patients with locally recurrent rectal cancer. Ann Surg Oncol. 2007. 14(2):447-454.
- Lambregts DM, Cappendijk VC, Maas M, Beets GL, Beets- Tan RG. Value of MRI and diffusion-weighted MRI for the diagnosis of locally recurrent rectal cancer. Eur Radiol. 2011. 21(6):1250-1258.
- Tan PL, Chan CL, Moore NR. Radiological appearances in the pelvis following rectal cancer surgery. Clin Radiol. 2005. 60(8):846-855.
- Pema PJ, Bennett WF, Bova JG, Warman P. CT vs MRI in diagnosis of recurrent rectosigmoid carcinoma. J Comput Assist Tomogr. 1994. 18(2):256- 261.
- Moore HG, Shoup M, Riedel E, Minsky BD, Alektiar KM, Ercolani M, et al. Colorectal cancer pelvic recurrences: determinants of resectability. Dis Colon Rectum. 2004. 47(10):1599-1606.
- Messiou C, Chalmers AG, Boyle K, Wilson D, Sagar P. Pre-operative MR assessment of recurrent rectal cancer. Br J Radiol. 2008. 81(966):468-473.
- Campos Hervás S. Papel de la RM en la estadificación local del cáncer de recto. En: Curso avanzado para operadores de RM. Valencia: ERESA Campanar. 2008. p. 17-26.
- Beets-Tan RG, Beets GL. Rectal cancer: review with emphasis on MR imaging. Radiology. 2004. 232:335-46.
- World Health Organization. The World Health Report 2003-Shaping the future. Geneva, Switzerland: World Health Organization; 2003.
- Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: Results of the MERCURY study. Radiology. 2007. 243:132-9.
- Park SH. Degree of error of thin-section MR in measuring extramural depth of tumor invasion in patients with rectal cancer. Radiology. 2008. 246:647-8.
- Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: Prospective observational study. BMJ. 2006. 333:779.
- Catalán V, Honorato B, García F, Bandrés E, Zabalegui N, Zárate R. Carcinogénesis colònica: proceso de transformación neoplásica. Rev Med Univ Navarra. 2003. 47(1):15-19.
- Fearon ER, Vogelstein B. A genetic model for colorrectal tumorogenesis. Cell. 1990. 61:759-767.
- Lledó S (ed) (2000). Guía clínica de Cirugía Colorrectal. Arán Ediciones S.A.
- lafrate F, Laghi A, Paolantonio P, Rengo M, Mercantini P, Ferri M et al. Preoperative staging of rectal cancer with MR Imaging: correlation with surgical and histopathologic findings. Radiographics. 2006. 26:701-714.
- Ho ML, Liu J, Narra V. Magnetic resonance imaging of rectal cancer. Clin Colon Rectal Surg. 2008. 21:178-187.
- McMahon CJ, Smith MP. Magnetic resonance imaging in locoregional staging of rectal adenocarcinoma. Semin Ultrasound CT MR. 2008. 29:433-453.
- Romero, E. M., Domínguez, S. A., Sánchez, M. D. J. D., Carmona, X. I., & Pérez, M. D. G. G. (2022). Utilidad de la resonancia magnética en la estadificación del cáncer de recto. Acta médica Grupo Ángeles, 20(3), 275-277.