Autora: Paula Emilia Bronn
Carrera de Especialista en Diagnóstico por Imágenes
Directora de la carrera: Dra. Marta Luján Kura
Resumen
Las lesiones cerebrales, así como los eventos embólicos e isquémicos a nivel del SNC, constituyen un alto riesgo en las personas que abusan de sustancias psicoactivas. Esta investigación se centra en profundizar en los métodos de diagnóstico por imagen ante casos vinculados con adicciones, a los fines de demostrar la utilidad de la radiología en este tipo de cuadros.
Se tomaron 24 artículos científicos de las bases de datos académicas como PubMed, Medline, Scielo, Dialnet, Seram y Google Scholar, considerando primordialmente estudios no superiores a diez años de publicación, si bien se incluyeron trabajos más antiguos por su relevancia teórica. Se tomaron artículos en inglés y en español. Se establecieron términos MeSH para localizar los estudios más relevantes vinculados con los objetivos de la investigación.
Se reportó una mayor frecuencia de daño cerebral y de eventos embólicos en el consumo de drogas como el alcohol, la cocaína, las metanfetaminas y los opioides. También se obtuvo que los estudios radiológicos más empleados para la detección y diagnóstico de lesiones en el cerebro del adicto se corresponden con la resonancia magnética (RM), la resonancia magnética funcional (RMf) y la tomografía computada (TC).
Como conclusión, podemos afirmar que las imágenes radiológicas tienen un papel preponderante en el manejo de los eventos cerebrales vinculados con adicciones a sustancias, tanto en el diagnóstico diferencial como en el seguimiento, ya que permiten intervenir con la precisión y rapidez que estos cuadros ameritan.
Palabras clave: imagenología del cerebro adicto, adicciones e imágenes cerebrales, efectos cerebrales de las drogas, enfermedades cerebrales por drogas.
Introducción
El consumo de sustancias psicoactivas representa en la actualidad uno de los mayores problemas de salud pública en los países desarrollados y subdesarrollados, que, además, lejos de disminuir, se ha incrementado en forma paulatina en los últimos años. Es un error asumir que el consumo abusivo de estas sustancias afecta a sectores marginales de la sociedad. Todo lo contrario, es un problema que afecta a una gran parte de la población laboral activa y a personas de todas las edades y géneros.
En la sociedad hay una alta frecuencia en cuanto al abuso de sustancias psicoactivas, en especial en la población joven. Según estudios, la Organización Mundial de la Salud (OMS) estima que alrededor de 275 millones de personas en todo el mundo consumieron drogas al menos una vez durante el año 2016, con una tendencia en aumento. Esto se agrega el excesivo consumo de sustancias psicoactivas ilegales y sintéticas, altamente adictivas, como los opioides, la cocaína, el cannabis y las metanfetaminas, entre otros.(1)
Los indicadores actuales están llamando la atención acerca de la temprana edad de experimentación y consumo de drogas en los adolescentes varones. No obstante, la literatura indica que las diferencias por género en el consumo de sustancias cada vez se acortan más, sobre todo en los adolescentes. (2)
El período de riesgo de inicio del consumo se concentra en la adolescencia mediana y tardía. Los adolescentes suelen comenzar a experimentar con drogas legales como primer eslabón para posteriormente usar sustancias de comercio ilegal. A su vez, este patrón tiene un alto grado de transición hacia el consumo regular de drogas ilícitas en los tres primeros años tras la experimentación.(2, 3)
Son diversos los factores que se involucran y se encuentran en la adicción a sustancias psicotrópicas. Puede estar relacionada con aspectos sociodemográficos como el sexo, la edad, el nivel educativo, los factores familiares, el estado convivencial, la influencia social y del ambiente, el consumo por parte de los pares y la disponibilidad de las sustancias al inicio del consumo.(3)
Este trabajo en particular se centra en las adicciones desde el punto de vista de los estudios imagenológicos, en el diagnóstico adecuado mediante los estudios radiológicos para una intervención acorde y rápida de casos que tienen origen en el abuso de sustancias psicoactivas.
En ese sentido, el objetivo general de esta investigación es profundizar en los métodos de diagnóstico por imagen ante casos vinculados con adicciones. A partir de esto, la hipótesis del estudio se orienta en demostrar que los estudios radiológicos de neuroimagen son una fuente imprescindible para el diagnóstico e intervención ante eventos neurológicos relacionados con el abuso de sustancias psicoactivas.
En ese marco, en primer orden se hace una conceptualización sobre las adicciones, sus mecanismos fisiológicos y factores predisponentes, para luego profundizar en los cambios neurológicos, que se pueden seguir a través de imágenes radiológicas, que ocurren a nivel del sistema nervioso central (SNC) del adicto. Posteriormente, se explica la utilidad de los estudios imagenológicos, en especial la resonancia magnética (RM), la RM funcional (RMf) y la tomografía computada (TC) en el diagnóstico de cuadros neurológicos vinculados con adicciones. El análisis bibliográfico permitió realizar el contraste de fuentes y establecer las conclusiones del estudio.
Objetivos
Objetivo general
Profundizar en los métodos de diagnóstico de neuroimagen ante casos vinculados con adicciones.
Objetivos específicos
- Explicar el uso de la neuroimagen en los casos relacionados con adicciones.
- Determinar los métodos de diagnóstico por imágenes más precisos para la intervención en accidentes vasculares ocasionados por abuso de sustancias psicoactivas.
Materiales y métodos
Este estudio se trata de una revisión documental de la literatura más actualizada sobre los estudios de imagen en las adicciones. Para los criterios de inclusión se realizó una selección de artículos científicos con alta confiabilidad académica, en inglés y otros idiomas, tomando en cuenta investigaciones nacionales y de otros países, con énfasis en los últimos cinco años.
Se tomaron 24 artículos científicos de bases de datos académicas como PubMed, Medline, Scielo, Dialnet, Seram y Google Scholar, considerando primordialmente estudios no superiores a diez años de publicación, pero incluyendo aquellos más antiguos por su relevancia teórica, en inglés, español y otros idiomas. Se utilizaron los siguientes términos MeSH: “cerebro del adicto”, “imagenología del cerebro del adicto”, “adicciones e imágenes cerebrales”, “efectos cerebrales de las drogas”, “enfermedades cerebrales por drogas”. Se incluyeron mayormente revisiones literarias sistemáticas, metaanálisis y estudios de casos, a los fines de localizar las controversias, así como las afinidades o consistencias de los estudios que permitiesen cumplir los objetivos de esta investigación y confirmar o negar la hipótesis propuesta.
Las investigaciones seleccionadas permitieron esclarecer los avances y posibilidades que ofrecen los estudios imagenológicos en la evaluación de los procesos cerebrales que generan las sustancias psicoactivas en el Sistema Nervioso Central (SNC), así como en la detección de mecanismos neurofisiológicos con patrones específicos para identificar patologías o eventos neurológicos vinculados con las adicciones.
Desarrollo
1. Las adicciones
El consumo de sustancias psicoactivas se ha convertido en una problemática crítica, que es centro de preocupación a nivel de organizaciones globales y al interior de países. Estas sustancias pueden ser objeto de consumo, uso o abuso entre personas de diferentes edades, grupos, y ante diversas circunstancias personales y sociales.
Para algunos teóricos del tema, las adicciones son una expresión de la sociedad actual, que cada vez demanda a las personas crecientes consumos.(4) La adicción se conceptualiza como:
[…] una situación en la cual una persona en forma compulsiva y repetitiva emplea de manera exclusiva y excluyente: ya sea, o una sustancia, que podría llegar a ser psicoactiva, u otra persona, o también, objetos y determinadas conductas, las cuales pueden constituir severas formas de adicción.(5)
Valga mencionar que la conceptualización sobre adicción postula que una dependencia no se produce solo a nivel de sustancias psicoactivas o drogas, sino que una conducta compulsiva y de necesidad exclusiva se genera también hacia múltiples objetos o situaciones, como el sexo, la necesidad compulsiva por comprar, los juegos de envite y azar, entre otras conductas de dependencia compulsiva.
De acuerdo con la Organización Mundial de la Salud (OMS), droga es toda sustancia que incorporada en el organismo provoca cambios en sus funciones. Asimismo, este organismo define la drogadependencia como un estado de intoxicación periódica o crónica producida por el consumo repetido de una droga natural o sintética.(6)
A nivel social se ha establecido una clasificación de las drogas sobre la base de tres estadios: las drogas o sustancias permitidas, las intermedias y las prohibidas. Según dicha categorización también conviene indicar que farmacológicamente las sustancias se han ordenado en arreglo a los efectos que producen en el organismo. Es así como existen sustancias depresoras, sustancias estimulantes, alucinógenas y cannabinoides. Cada una se vincula con el efecto que generan a nivel del sistema nervioso central, siendo los niveles de consumo: uso, abuso y adicción(6) (ver Tabla 1).
Tabla 1. Las sustancias psicoactivas y sus efectos en el SNC
| S. depresoras | S. estimulantes | S. alucinógenas | Cannabinoides |
|
Alcohol Hipnóticos Ansiolíticos: benzodiazepinas Opiáceos: heroína, morfina, codeína, metadona Tranquilizantes Inhalantes |
Anfetaminas Nicotina Cocaína y sus derivados Xantinas: cafeína teobromina Éxtasis |
LSD Mescalina Éxtasis Ketamina |
Marihuana Hachís |
Tabla 1. Clasificación de las sustancias según su efecto sobre el sistema nervioso.(6)
Las depresoras son aquellas que desaceleran el funcionamiento y la velocidad de la actividad mental y de ciertas funciones físicas, enlentecen o deprimen el funcionamiento del SNC. Sus efectos incluyen relajar el SNC, y en dosis pequeñas generan euforia, mientras que en dosis elevadas pueden provocar aturdimiento y apatía. Asimismo, impulsan la disminución de la tensión y la desaparición de la angustia, entre otros efectos.(6)
En cuanto a las sustancias llamadas estimulantes, la OMS (2004) destaca que estas aceleran o estimulan el funcionamiento del SNC mediante la liberación por parte de las de células nerviosas de neurotransmisores estimulantes. En cuanto a los efectos, resaltan que producen mejoría del estado de ánimo con mayor sensación de felicidad y disminución del apetito. Estas sustancias mantienen al individuo despierto y activan el metabolismo con un aumento de las pulsaciones del corazón.(6)
Asimismo, hay sustancias conocidas como perturbadoras o alucinógenas. Estas distorsionan la percepción de la realidad y alteran significativamente la química cerebral, generando alteraciones visuales, táctiles y auditivas. Sus efectos son la modificación de la noción de tiempo y espacio, producir exageración de las percepciones sensoriales, en especial de los sentidos de la vista y del oído.
Las consecuencias relacionadas con cada una de las sustancias son las siguientes: el llamado PCP, o Polvo de Ángel, produce pánico, paranoia, estados psicóticos, depresión y crisis de angustia; el Peyote y la Psilocybina causan depresión cardiaca, dolor de cabeza, disminución del ritmo respiratorio y contracciones intestinales; el LSD estimula el delirio, terror, pánico, paranoia, trastornos en la visión, hipertensión arterial (HTA), problemas respiratorios, crisis psicóticas y alucinaciones visuales. Finalmente, la marihuana reduce el impulso sexual, induce la apatía, provoca lentitud, torpeza, pereza, disminución de la atención/concentración y trastornos de la memoria.(6)
2. Mecanismos neurofisiológicos de las adicciones
La adicción a las drogas comprende un ciclo recurrente de intoxicación, atracones, abstinencia y deseo que resulta en un uso excesivo o abuso de drogas a pesar de las consecuencias adversas.(7) Esto se debe a que las drogas tienen un efecto de refuerzo positivo común que activa los circuitos de recompensa endógenos y el individuo busca obtener este efecto de recompensa a partir de su consumo.
Las sustancias psicoactivas tienen la posibilidad de regular o modular la actividad del sistema dopaminérgico mesolímbico cortical. Esto viene dado porque todas las drogas producen un incremento de dopamina, o hiperdopaminergia, en la vía que comunica las neuronas dopaminérgicas mesencefálicas del área tegmental ventral (VTA) del núcleo accumbens de dicho sistema.(8)
En las primeras etapas la búsqueda y el consumo siempre va a ser un estímulo para mayor placer. En las situaciones abusivas o dependientes, cuando la droga (el objeto) configurase la sustitución subjetiva hacia la propia persona, es cuando su consumo se va a convertir en problemático y doloroso.(8)
En ese sentido, la dopamina es el neurotransmisor fundamental implicado en los efectos reforzantes de las drogas de abuso, debido a que produce recompensa cerebral y sobreexcitación, específicamente en los circuitos del sistema límbico. Desde este sistema se regulan los procesos emocionales y motivacionales que, en el caso del adicto, van a generar el deseo compulsivo de consumo o craving por obtener la droga en períodos de abstinencia.(8)
Como se ha indicado, las drogas de abuso incrementan la actividad eléctrica de las neuronas dopaminérgicas del VTA y la liberación de dopamina en sus campos de proyección, como en el shell del núcleo accumbens.(8) Asimismo, las neuronas dopaminérgicas se proyectan hacia otras estructuras del sistema límbico, donde hay archivos de memoria que sirven como reforzador de la autoadministración y por ende optimizan la consecución de una futura recompensa.(9)
A nivel intracelular, diversos sistemas de neuropéptidos se activan como consecuencia del consumo continuado de drogas. En ese sentido, todas las drogas producen un incremento de la transmisión mediada por el factor liberador de corticotrofina o CRF durante los períodos de abstinencia.(9) Este neuropéptido se activa en respuesta al estrés, lo que podría ser el mecanismo responsable de la ansiedad y negatividad afectiva de adictos durante los períodos de abstinencia. A esto se suma la activación de otras neuronas, como las GABAérgicas, en el caso del consumo de etanol, las cuales contienen el péptido opioide dinorfina, que al ser liberado inhibe la activación de las dopaminérgicas y en consecuencia produce una disminución en la liberación de dopamina en el núcleo accumbens. Todo esto contribuye a la hipoactividad dopaminérgica de los adictos en períodos de abstinencia.(9)
Del mismo modo, la exposición aguda a la droga activa los circuitos corticales del sistema límbico cortical a través de múltiples caminos paralelos en los que se integran señales intero y extero receptivas asociadas a la autoadministración de sustancias psicoactivas con las memorias previas relacionadas con la experiencia en curso.(8)
Todas estas modificaciones posibilitan la incidencia de un estado motivacional negativo (anhedonia, disforia, ansiedad, irritabilidad) en los períodos de abstinencia o craving, lo que potencia el ciclo adictivo. En cuanto a las modificaciones intracelulares o expresiones génicas ocasionadas por el consumo continuado, se encuentra el CREB o factor de transcripción que se fija en dímeros dentro de secuencias específicas de ADN. Este factor se activa debido al estrés inducido por las drogas de abuso en distintas regiones del SNC, en particular en el núcleo accumbens. Este proceso repercute en la anhedonia y en los estados amotivacionales del periodo de abstinencia.(10)
También se suceden otras modificaciones, como el αfosβ, que se convierte en proteína con el refuerzo positivo de drogas, estimulando con ello aún más el deseo de consumo. La acumulación αfosβ afecta otras enzimas, como la quinasa, dependiente de la ciclina (Cdk5), que es responsable del crecimiento y supervivencia neuronal. Esta maladaptación produce uno de los efectos de las drogas de abuso relacionadas con las alteraciones cognitivas. Cabe indicar que tanto el CREB como el αfosβ son factores de transcripción que se activan por el consumo crónico.(10)
En consecuencia, las drogas de abuso producen cambios maladaptativos en redes complejas que ocasionan alteraciones conductuales de la adicción y con ello la perdurabilidad de la dependencia.
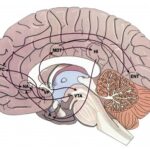
3. Factores predisponentes
Se recabaron en la teoría tres áreas de estudio principales: la relación entre conducta y genética, la expresividad emocional y la interacción con la dinámica familiar. En ese sentido, la asociación de los factores biológicos, psicológicos, sociales o contextuales, especialmente familiares, escolares y grupales, favorecen la consolidación de un patrón de abuso o consumo problemático de sustancias.(12)
El ambiente familiar y social que atraviese cada individuo determinará el desarrollo de su personalidad individual. En tal sentido, existe una recurrencia de la patología con los factores ambientales en la infancia, en especial en familias problemáticas, en las que existen conflictos, separaciones o situaciones de violencia, que se vinculan con el desarrollo de problemas de conducta y el consumo de sustancias.(13)
La literatura sobre el tema refiere patrones comunes en los casos de drogadicción. En cuanto a las adicciones a las drogas y su vinculación familiar, los casos se presentan mayormente en la adolescencia. Esta etapa de la vida constituye un punto crucial dentro del ciclo vital familiar, en tanto el hijo o la hija tiende a separarse de la familia, es decir, a resolver la cuestión edípica instalada.(14)
Otro factor de riesgo lo constituye el consumo de alcohol por parte del padre o madre, así como problemas en la relación padre-madre que involucren situaciones de violencia y hostilidad. En síntesis, en los factores familiares se incluyen aspectos como: interacción simbiótica en la relación madre-hijo, coalición intergeneracional (alianzas confabuladoras madre-hijo vs. padre), padre periférico. Todo esto convierte a la familia en el origen de los problemas vinculados al consumo de sustancias estupefacientes de parte de integrantes del núcleo familiar.(14)
En ese sentido, los factores familiares constituyen un elemento importante y predictivo del consumo de sustancias, dado que el uso de drogas de parte de padres, hermanos o familiares cercanos, así como las problemáticas familiares relativas a vigilancia o las relaciones de parentalidad, se han identificado como elementos recurrentes en los sujetos adictos.(14)
4. Neuroimagen y adicción
Como se indicó en apartados anteriores, las adicciones son un ciclo recurrente que involucra cambios neurológicos y neuroplásticos en los sistemas de recompensa cerebral. También inducen respuestas frente al estrés y las funciones ejecutivas. Los estudios de neuroimagen reflejan los cambios que se producen en el SNC en individuos adictos.(15)
La RM constituye un medio no invasivo para explorar la forma, el tamaño y la integridad de la macroestructura de la sustancia gris y blanca del cerebro. De igual forma, la RM funcional (RMf) detecta la activación de zonas específicas en la estructura del cerebro, mientras que la tomografía computada (TC) ofrece una evidencia primordial en cuanto a las alteraciones cerebrales microestructurales vinculadas con abuso de drogas.(16)
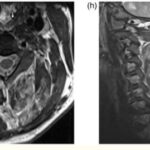
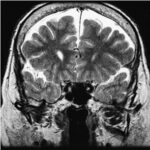
Se pueden mencionar al respecto los estudios que han encontrado en pacientes dependientes al alcohol una disminución del volumen de sustancia gris en el área de la corteza frontal, el hipocampo y el tálamo. El volumen de las sustancias blanca y gris también se puede ver disminuido en el área periventricular, la protuberancia y el cerebelo. Estos déficits de volumen también se han localizado en la corteza prefrontal dorsolateral derecha, ínsula anterior derecha, en el núcleo accumbens y en la amígdala izquierda(16) (ver Imagen 1).
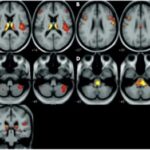
Asimismo, como se indicó previamente, a través de la TC también se puede observar el deterioro de la microestructura cerebral por adicción al alcohol. El abuso de esta sustancia altera cinco fibras del cerebro, como el cuerpo calloso, el fondo de saco, la cápsula externa, el cíngulo circunvolución y el fascículo longitudinal superior, las que están involucradas en funciones como el procesamiento visoespacial y del lenguaje, la comunicación interhemisférica, la memoria, el procesamiento emocional, la toma de decisiones y la integración sensorial(16) (ver Imagen 2).
La mayoría de los estudios clínicos vinculados con las adicciones se centran en analizar las áreas de dopamina del mesencéfalo, principalmente el área tegmental ventral y la sustancia negra, así como las estructuras de los ganglios basales, como el estriado ventral (donde se encuentra el núcleo accumbens) y el estriado dorsal, en cuyas áreas se activan los circuitos de recompensa, el acondicionamiento o adaptación y la formación del hábito de adicción.(7)
En primer lugar, se puede tratar el caso de los adictos al cannabis, cuya droga tiene efectos sobre el sistema endocannabinoide y en las áreas cerebrales vinculadas con la regulación de las emociones y el estrés. Un estudio de casos y control demostró mediante tomografía por emisión de positrones (PET) cómo la exposición crónica al cannabis, específicamente al THC, reduce la respuesta cerebral a la dopamina, y por ende, mayor puntuación de emocionalidad negativa en los adictos a esta sustancia respecto de los que no lo son. Esto se demostró con el uso de fármacos estimulantes, como el metilfenidato. Este mismo fenómeno también se ha observado con drogas como el alcohol, la cocaína y la nicotina. El cannabis también ocasiona una disminución en el metabolismo de la glucosa cerebral en el cuerpo estriado, tálamo y mesencéfalo(15) (ver Imagen 3).
Otros estudios imagenológicos vienen destacando el papel de la corteza prefrontal (CPF) en las adicciones. La alteración de esta zona ocasiona un síndrome de inhibición de la respuesta alterada y atribución de prominencia en la adicción. Este síndrome particularmente se caracteriza por atribuir una importancia excesiva al fármaco y a las señales relacionadas con el mismo, así como menor sensibilidad a los reforzadores no farmacológicos y menor capacidad para inhibir conductas desadaptativas o desventajosas. Como consecuencia de esto, la búsqueda y consumo de drogas ocurre a expensas de otras actividades y genera conductas extremas para obtener la sustancia.(7)
A propósito de lo anterior, una investigación realizó un análisis sistemático sobre estudios de tomografía por emisión de positrones (TEP) y resonancia magnética funcional (RMf) centradas en la CPF en relación con adicciones. Se incluyó la corteza orbitofrontal (COF), la corteza cingulada anterior (CAA) y la corteza prefrontal dorsolateral (CPFDL).(7)
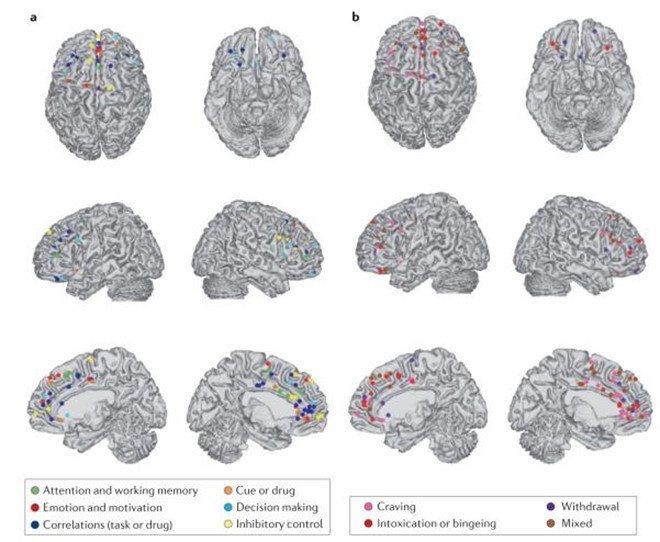
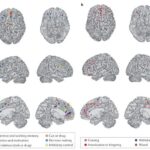
En este estudio que se viene comentando, las áreas de la CPF muestran diferencias actividades entre individuos con adicción y casos controles saludables durante tareas que involucran atención y memoria de trabajo (verde), toma de decisiones (azul claro), control inhibitorio (amarillo), emoción y motivación (rojo) y la reactividad de la señal y la administración del fármaco (naranja). Además, en algunas áreas de la CPF, la actividad se correlaciona con el desempeño de la tarea o el uso de drogas (azul oscuro)(7) (ver Imagen 4-a).
De igual forma, en este mismo estudio se evidenciaron cambios en la actividad cerebral relacionados con las características clínicas de la adicción, incluida la intoxicación y los atracones (rojo, considerando que las drogas se usaron dentro de las 48 horas posteriores al estudio), la ansiedad (rosa, las drogas se usaron una o dos semanas antes del estudio) y la abstinencia (púrpura, los medicamentos se usaron más de tres semanas antes del estudio(7) (ver Imagen 4-b).
5. Diagnósticos por imágenes en el cerebro del adicto
Las sustancias psicoactivas son múltiples y los efectos que producen son variados, como se explicó en apartados anteriores. En el área radiológica se pueden encontrar patrones específicos para identificar patologías o eventos neurológicos vinculados con las adicciones o el abuso de sustancias psicotrópicas. Las diversas técnicas radiológicas, como la resonancia magnética (RM), la resonancia magnética funcional (RMf) y la tomografía computada (TC), evidencian el deterioro funcional o metabólico del SNC ocasionado por el abuso de drogas ilegales.(17)
Existen sustancias que generan mecanismos fisiopatológicos complejos con consecuencias para la persona. Dentro de estas, se puede mencionar la cocaína, cuya vía de administración por lo general es intranasal. Esta bloquea la recaptación de serotonina y de los transportadores de la dopamina, aumentando con ello sus concentraciones extracelulares, sobre todo en el núcleo accumbens. Su adicción obedece al rápido efecto que tiene tras su consumo, produciendo en el sujeto una sensación inmediata de euforia.(18)
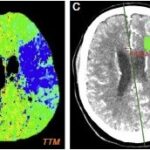
Las principales complicaciones de la cocaína son vasculares, en especial la hemorragia subaracnoidea (HSA), y la intraparenquimatosa o infarto isquémico, principalmente debido a la vasoconstricción o el vasoespasmo. Valga mencionar que la HSA es una enfermedad cerebrovascular de carácter agudo, que se presenta mediante derrame cerebral hemorrágico. Hay un subtipo denominado HSA aneurismática (HSAa), que es no traumática, cuyas causas pueden ser múltiples, incluyendo la adicción a las drogas. Esta tiene un efecto potencialmente destructivo a nivel del SNC y su tasa de muerte es del 60% de los casos en las primeras 48 horas de la hemorragia.(19)
La HSAa representa entre el 3% y el 5% de todos los accidentes cerebrovasculares (ACV). Suele ocurrir en personas jóvenes y solo un 30% recupera las habilidades cognitivas, de memoria y funcionales en general. Es frecuente el retraso neurológico y la pérdida de la calidad de vida en los sobrevivientes.(20) El 50% de los consumidores de esta sustancia presenta patologías vasculares subyacentes, como HSAa y malformaciones vasculares.(17, 18)
Los estudios de TC permiten evidenciar los accidentes cerebrovasculares (ACV) ocasionados por el abuso de la cocaína. Por caso, se localizó en la literatura imágenes que permiten ver el ACV isquémico agudo de la arteria cerebral media izquierda de un paciente. La TC sin contraste intravenoso visualiza la hipodensidad de la cabeza del caudado, del núcleo lenticular y de la ínsula izquierda. También se realizaron estudios de RM, que permiten observar la restricción del área isquémica en el territorio silviano(18) (ver Imagen 5).
Los consumidores habituales de cocaína suelen tener un pico de presión arterial sistólica elevada y un aumento de la frecuencia cardíaca tras el consumo, que los hace propensos a sufrir malformaciones arterovenosas. Al mismo tiempo, si esta sustancia se combina con etanol, las probabilidad de padecer una hemorragia subaracnoidea se incrementan. A propósito, se puede mencionar el caso de una paciente de 33 años de edad con síntomas de cefalea intensa y hemiparesia izquierda, en cuyo análisis de tóxicos de orina se detectó cocaína.(18)
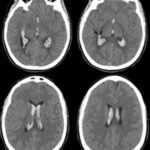
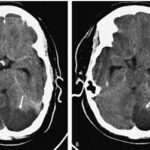
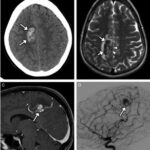
En el caso que se viene reseñando, se realizó TC sin contraste para evidenciar eventuales daños isquémicos. En este estudio se localizó un hematoma intraparenquimatoso (ver Imagen 6). Este tipo de hematomas tiene un significativo riesgo para la persona, dado que puede avanzar hacia hemorragias con daño en la barrera hematoencefálica e incremento de la presión intracraneal, que puede ocasionar déficit neurológico e incluso la muerte.(17, 18)
En los casos de personas sin patología vascular subyacente, las hemorragias intraparenquimatosas se localizan con mayor frecuencia en los ganglios basales y el tálamo. Un caso como este se obtuvo en la literatura, correspondiente a una mujer de 23 años que sufrió una hemiplejía completa. Se le localizaron cantidades considerables de cocaína en el análisis de orina. La RM evidenció una isquemia en la rama MCA derecha con afectación de los ganglios basales(17) (ver Imagen 7).
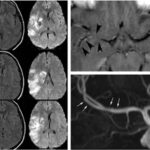
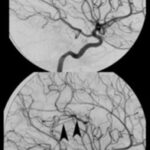
Otro caso que conviene referir es el de una mujer de 19 años, quien acudió al servicio de guardia por dolor de cabeza agudo. Se le realizó una TC que mostró una hemorragia intraventricular con un posible componente parenquimatoso cerca de la pared del ventrículo derecho, a partir del abuso de cocaína en combinación con alcohol (ver Imagen 8). De igual modo, la angiografía evidenció una malformación arteriovenosa coroidea alimentada por la arteria coroidea lateral posterior(17) (ver Imagen 9).
Asimismo, también existen otras drogas que producen isquemia cerebral a largo plazo y otras complicaciones estructurales y funcionales del SNC, como hemorragias, a causa del aumento de la presión arterial que producen las drogas de abuso. Esto sucede con la anfetamina y sus derivados, la metanfetamina y el MDMA (3,4- metilendioximetanfetamina), conocido también como “éxtasis” o “cristal”, cuya vía de administración es en polvo o en pastillas.(18)
El consumo abusivo de metanfetaminas o MDMA puede generar un mayor riesgo de rotura de malformaciones arteriovenosas y aneurismas preexistentes, a causa de la vasoconstricción en la microcirculación cerebral, provocando necrosis del tejido. Las áreas que más se pueden afectar son el globo pálido y la corteza occipital.(18)
En la literatura se encontró caso de una mujer de 42 años, consumidora esporádica de MDMA, quien acudió a la guardia con síntomas de cefalea, alteración visual e hipertensión por síndrome de encefalopatía posterior reversible. Las imágenes radiológicas permitieron observar edema córtico-subcortical bilateral confluente de predominio parieto-occipital posterior. A partir de las imágenes radiológicas se pudo intervenir a través de un tratamiento con soporte y control de la presión arterial. (18) (ver Imagen 10).
Asimismo, una investigación encontró patrones comunes de lesiones cerebrales a través de la neuroimagen mediante una recopilación extensa de estudios radiológicos vinculados con casos de adolescentes con problemas de adicción a sustancias psicoactivas ilegales, desde 2006 hasta 2016. El estudio constató dos patrones coincidentes. El primero fue la lesión cerebral difusa simétrica de la sustancia blanca subcortical con afectación cerebelosa preferencial, o leucoencefalopatía. El segundo lo constituyen múltiples focos de infartos isquémicos en una distribución territorial no arterial patrón isquémico.(21)
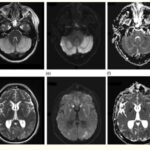
En esta investigación que se viene señalando, se puede mencionar el caso de un joven de 16 años, con alteración aguda del estado mental por inhalación de vapor de heroína. Se le efectuó una RM que evidenció hiperintensidades en T2 de la sustancia blanca simétrica difusa infratentorial y supratentorial. El diagnóstico clínico en este caso fue rabdomiólisis, que afecta predominantemente la musculatura posterior del cuello(21) (ver Imágenes 11 y 12).
Otro caso que merece ser comentado es el de un adolescente de 15 años que presentó encefalopatía y signos extrapiramidales por ingestión de metadona. La RM evidenció focos de infartos agudos en el caudado y putamen, así como infartos corticales de la línea divisoria de aguas parietales(21) (ver Imagen 13).
De igual modo, los opioides también tienen efectos neurotóxicos sobre el SNC. Este grupo de drogas incluye heroína, morfina, hidrocodonas, oxicodona, hidromorfina, codeína y otros narcóticos, como fentanilo, meperidina, metadona y opio. Los adictos a estas drogas buscan los efectos eufóricos que producen al tiempo que intentan evitar los síntomas de abstinencia. Estos fármacos se pueden administrar por vía oral o inyectable.(22)
Los daños de los opioides sobre el SNC son visibles mediante estudios de RM. Esta técnica imagenológica permite determinar el diagnóstico subyacente a la neurotoxicidad, como la isquemia, que es la complicación aguda más frecuente en casos de adictos. El riesgo de un evento isquémico es mayor con administración intravenosa en comparación con otras vías como la inhalación.(22)
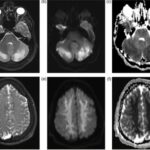
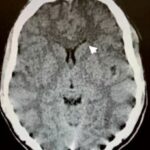
En relación con este tipo de drogas, se puede citar el reporte de un caso de intoxicación de un varón de 16 años por consumo de píldoras de oxicodona. La TC permitió visualizar la hipodensidad en núcleos caudados, así como una rabdomiólisis de etiología inflamatoria o infecciosa (ver Imagen 14). El paciente presentó otros signos como escasa coordinación, pérdida de conocimiento y dificultad para respirar, que se resolvió en pocos días con intubación y asistencia ventilatoria.(23)
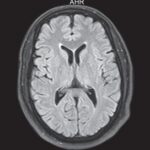
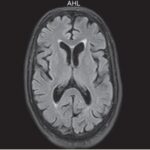
En el caso que se viene ilustrando, la RM mostró T2 difuso con hiperintensidades en el cuerpo calloso bilateral frontal y parietal, así como lesión difusa de la sustancia blanca del cerebelo. Se localizaron áreas de difusión restringida en los ganglios basales bilaterales, lo cual tenía relación con la pérdida neuronal mediada por estrés oxidativo (ver Imágenes 15 y 16). El tratamiento permitió la recuperación progresiva del habla y la orientación de la persona. (23)
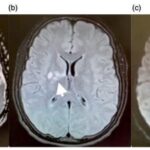
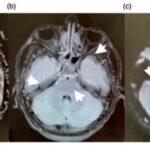
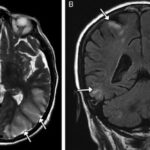
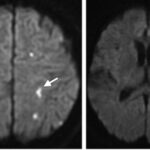
Asimismo, la adicción a la heroína también genera afectaciones a nivel del SNC, provocando secuelas neurovasculares agudas y crónicas, como leucoencefalopatías, atrofia e infección. Las complicaciones agudas, como los ACV o la isquemia, suceden generalmente con la administración intravenosa de esta sustancia, que produce vasoespasmo, vasculitis y eventos embólicos.(22, 24) Se puede mencionar el caso de una mujer de 48 años con antecedentes de abuso de heroína, quien sufrió infarto agudo de divisoria de aguas con afectación de los lóbulos frontales y el justo caudal(24) (ver Imagen 17).
Entre el 5% y el 10% de las personas que tienen infartos asociados a la heroína se involucran globus pallidus o los ganglios basales. De igual forma, con la adicción a esta sustancia ocurren cambios isquémicos crónicos, a menudo son subclínicos, que se desarrollan a partir de estructuras microvasculares a largo plazo(24) (ver Imagen 18).
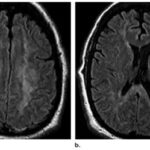
La leucoencefalopatía subaguda es un cuadro clínico que se genera con la administración de heroína precalentada inhalada. La sustancia se coloca sobre un papel aluminio, se calienta, y estos vapores emergentes son inhalados. Asimismo, esta sustancia genera cambios en la estructura cerebral, como el agrandamiento ventricular. Además, la droga provoca infecciones en el SNC secundarias a endocarditis por la inyección intravenosa de microorganismos, lo cual al mismo tiempo propicia complicaciones neurológicas, siendo el organismo más involucrado el Staphylococcus aureus.(22)
La endocarditis provoca infartos en el SNC debido a la oclusión de émbolos sépticos, aneurismas micóticos y en menor medida abscesos cerebrales(22) (ver Imagen 19). La heroína también provoca atrofias severas a nivel cerebral, como surcos y espacios subaracnoideos en los lóbulos frontal y temporal (ver Imagen 20).
Como se evidencia en la imagen anterior, los opioides producen daños estructurales en el SNC, como la atrofia cerebral, que a su vez tiene una asociación con la edad y la duración de la adicción. Conviene mencionar una investigación retrospectiva que empleó 40 pacientes con abuso de opioides, con el propósito de evaluar la asociación entre el abuso crónico de estas drogas y la atrofia cerebral, utilizando los estudios radiológicos de los pacientes. Los casos se evaluaron durante dos años y se incluyeron pacientes ingresados en Unidad de Cuidados Intensivos (UCI).(1)
En el estudio indicado, se encontró que la mayoría de los consumidores (35%) tenía una edad que oscilaba entre los 36 y 40 años. Los 40 pacientes incluidos en el estudio eran adictos crónicos de opiáceos, de los cuales 25 tenían atrofia cerebral de leve a grave. De estos, 25 sujetos (62,5%) mostraron evidencia radiológica de atrofia cerebral, mientras que los 15 restantes no tenían signos que sugirieran atrofia cerebral. Entre los que tenían atrofia cerebral, 14 presentaban de grado I, 7 tenían atrofia cerebral de grado II, III y IV(1) (ver Imágenes 20 y 21).
Los estudios observados indican que las alteraciones macroestructurales y microestructurales cerebrales tienen relación con la duración del abuso o la adicción a las sustancias ilegales, siendo los riesgos más importantes la alteración de la densidad de las sustancias gris y blanca, la afectación de los ganglios basales. Estos problemas inciden además en las isquemias, los infartos cerebrales y eventos embólicos que provocan las drogas de abuso.
Resultados
En esta investigación se utilizaron 24 estudios de carácter científico y académico encontrados en bases de datos especializadas y confiables, como PubMed, Medline, Scielo, Dialnet, Seram (Sociedad Española de Radiología Médica) y Google Scholar. Las investigaciones incluidas se correspondieron mayormente con revisiones bibliográficas sistemáticas o estudios teóricos, estudios de cohorte y reportes de casos (ver Gráfico 1).
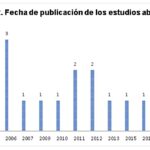
En relación con los años de publicación, la mayoría de los estudios se correspondieron con estudios no superiores a diez años, pero se consideraron algunos de mayor antigüedad por su relevancia teórica y aportes a esta investigación (ver Gráfico 2).
En relación con las drogas de abuso que más daño producen a nivel del SNC, los estudios reportaron con mayor frecuencia el alcohol, la cocaína, el MDMA y las metanfetaminas y los opioides como los tipos de sustancias ilegales que más problemas estructurales generan a nivel cerebral. Estas también se señalan como la causa primordial de eventos embólicos, vasoespasmos, hemorragias subaracnoideas, isquemias y demás eventos vasculares (ver Gráfico 3).
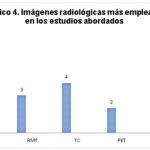
Asimismo, los estudios radiológicos más empleados en los estudios analizados para la detección y diagnóstico de lesiones en el cerebro del adicto se corresponden con la resonancia magnética (RM), la resonancia magnética funcional (RMf) y la tomografía computada (TC) (ver Gráfico 4).
Discusión
Esta investigación se propuso como objetivo general profundizar en los métodos de diagnóstico por imagen ante casos vinculados con adicciones. En ese sentido, la hipótesis del estudio consistió en demostrar que los estudios radiológicos de neuroimagen son una fuente imprescindible para el diagnóstico e intervención ante eventos neurológicos relacionados con el abuso de sustancias psicoactivas.
En ese marco, el primer objetivo específico fue explicar el uso de la neuroimagen en los casos relacionados con adicciones. En este aspecto debe indicarse que los estudios imagenológicos constituyen una fuente de importancia para ubicar la afectación que ejercen las drogas de abuso a nivel del SNC. En estudios que emplearon RMf y TC se pudo evidenciar la forma en que estas imágenes contribuyen a visualizar la macroestructura cerebral y concretamente evidencian la alteración de la densidad de las materias gris y blanca del cerebro a causa de las adicciones.(15, 16)
De igual forma, la resonancia magnética funcional (RMf) detecta la activación de zonas específicas en la estructura del cerebro, mientras que la tomografía computada (TC) ofrece una evidencia primordial en cuanto a las alteraciones cerebrales microestructurales vinculadas con abuso de drogas. Otros estudios demostraron que las drogas ejercen acción sobre distintas zonas del cerebro, como la corteza prefrontal, el tálamo, la ínsula, el frontal medio circunvolución, la circunvolución precentral, el cerebelo, el tronco encefálico, el hipocampo dorsal, el mesencéfalo, los ganglios basales.(7, 15, 16)
De tal modo, los estudios de imágenes constituyen un aporte valioso para observar la afectación de diversas zonas cerebrales, las cuales inciden en múltiples funciones, como la atención, la memoria, la toma de decisiones, el control inhibitorio, las emociones, el procesamiento visoespacial y la motivación, entre muchas otras.
El segundo objetivo específico de esta investigación consistió en determinar los métodos de diagnóstico por imágenes más precisos para la intervención en accidentes vasculares ocasionados por abuso de sustancias psicoactivas. Las revisiones sistemáticas y los reportes de casos abordados permitieron demostrar que las imágenes como la RM, la RMf, la TC y en menor medida la PET, son útiles en el diagnóstico, evaluación y seguimiento en casos de eventos vinculados con abuso de sustancias psicoactivas.
Hubo una coincidencia en cuanto a que el estudio imagenológico por excelencia para observar las alteraciones cerebrales de las adicciones o los eventos isquémicos y vasculares que ocasionan es la resonancia magnética (RM).(18-24) Esta imagen constituye un aporte valioso para detectar eventos vinculados al abuso de drogas ilegales sintéticas como cocaína, opioides o metanfetamina, cuyo abuso genera un alto riesgo de provocar isquemias e infartos cerebrales.
De igual modo, la RM en combinación con la TC permite visualizar los eventos isquémicos, como ACV agudo, y diagnosticar entidades como la encefalopatía, leucoencefalopatía o edemas intraparenquimatosos que pueden derivar en hemorragias.(21-24) Estas suelen presentarse con alteraciones en la hipodensidad del caudado, el núcleo lenticular, la ínsula izquierda.
Otros elementos de la estructura cerebral afectados por el abuso de drogas son las sustancias gris y blanca y los ganglios basales, cuyas zonas afectadas pueden observarse a través de la RM. Esto permite determinar la severidad de atrofias cerebrales provocadas por las adicciones a drogas sintéticas.(23-24)
Conclusiones
Este estudio pudo determinar el papel determinante que tienen las imágenes radiológicas en el manejo de casos relacionados con adicciones a drogas. La radiología resulta de importancia para visualizar las lesiones cerebrales como consecuencia de abuso de sustancias a los fines de intervenir según sea el caso.
Se determinó que los estudios más empleados y precisos para visualizar alteraciones en la estructura cerebral son la resonancia magnética (RM) y la resonancia magnética funcional (RMf), ya que ofrecen con nitidez el estado de distintas áreas del SNC, como la corteza prefrontal, los lóbulos frontales, el justo caudal, el hipocampo, la ínsula, la materia gris y blanca, el mesencéfalo y los ganglios basales, zonas que suelen verse afectadas por eventos isquémicos, trombóticos o vasoespasmos originados por el abuso de drogas.
Debe decirse que los imágenes radiológicas tienen un papel preponderante en el manejo de los eventos cerebrales vinculados con adicciones a sustancias, tanto en el diagnóstico diferencial como en el seguimiento, ya que permiten intervenir con la precisión y rapidez que estos cuadros ameritan.
Referencias bibliográficas
- Singla, A., Singh, P., Panditrao, M. y Panditrao M. (2020). Is Chronic Opioid Abuse Associated with Cerebral Atrophy? An Observational Study. Indian J Crit Care Med, 24, 276-280.
- Hernández, L. T., Roldán, F. J., Jiménez, F. A., Rodríguez, M. C., Escarpa, S. D. y Pérez, A. M. (2009). La edad de inicio en el consumo de drogas, un indicador de consumo problemático. Interv Psicosoc, 8, 199-212.
- Cogollo-Milanés, Z., Arrieta-Vergara, K., Blanco-Bayuelo, S., Ramos-Martínez, L., Zapata, K. y Rodríguez-Berrío, Y. (2011). Factores psicosociales asociados al consumo de sustancias en estudiantes de una universidad pública. Rev Salud Pública, 13, 470-479.
- Bauman, Z. (2007). Vida de consumo. México, Fondo de Cultura Económica,.
- Área de Adicciones de la Dirección Nacional de Salud Mental y Adicciones, CABA (2015). Lineamientos para el abordaje de las adicciones en general y de la prevención en particular, s.n.
- OMS-OPS (2004). Neurociencia del consumo y dependencia de sustancias psicoactivas. https://www.who.int/substance_abuse/publications/neuroscience_spanish.pdf.
- Goldstein, R. Z. y Volkow, N. D. (2011). Dysfunction of the prefrontal cortex in addiction: neuroimaging findings and clinical implications. Nat Rev Neurosci, 12, 652-669.
- Barrondo, S., López, M. y Meana, J. (2006). Neurotransmisores y mensajeros intracelulares. Sociedad Española de Toxicomanía. Tratado SET de trastornos adictivos. Buenos Aires, Editorial Médica Panamericana.
- Rodríguez, F. (2006). Neuroanatomía funcional. Sociedad Española de Toxicomanía. Tratado SET de trastornos adictivos. Buenos Aires, Editorial Médica Panamericana.
- Haro, G., Prades, I., Benito, A. y Mateu, C. (2006).Genética. Tratado SET de trastornos adictivos. Buenos Aires, Editorial Médica Panamericana.
- Neiman, J., Haapaniemi, H. y Hillbom, M. (2000). Neurological complications of drug abuse: pathophysiological mechanisms. Eur J Neurol, 7, 595-606.
- Mosquera, D. y González, A. (2013). Del apego temprao a los síntomas del trastorno límite de personalidad. Rev Dig Medic Psico Psicot, 3, 1-35.
- Bowlby, J. (2012). Una base segura. Aplicaciones clínicas de una teoría del apego. Buenos Aires, Paidós.
- Sáenz, R. y Mario, A. (2003). Aportes sobre la familia del farmacodependiente. Rev Cienc Soc, 99, 25-44.
- Zehra, A., Burns, J., Liu, C., Manza, P., Wiers, C. et al. (2018). Cannabis Addiction and the Brain: a Review. J Neuroimmune Pharmacol, 13, 438-452.
- Dupuy, M. y Chanraud, S. (2016). Imaging the Addicted Brain: Alcohol. Int Rev Neurobiol, 129, 1-31.
- Geibprasert, S., Gallucci, M. y Krings, T. (2010). Addictive illegal drugs: structural neuroimaging. AJNR Am J Neuroradiol, 31, 803-808.
- El cerebro adicto: imágenes de las complicaciones neurológicas del abuso de drogas recreativas. Montoya-Filardi A &, Mazón M. 1, 2017, Vol. 59, págs. 17-30.
- Burkhardt, J. K., Chen, X., Winkler, E. A. et al. (2018). Early Hemodynamic Changes Based on Initial Color-Coding Angiography as a Predictor for Developing Subsequent Symptomatic Vasospasm After Aneurysmal Subarachnoid Hemorrhage. World Neurosurgery, 109, e363-e373.
- Chamling, B., Gross, S. y Stoffel-Wagner, B. (2017). Early Diagnosis of Delayed Cerebral Ischemia: Possible Relevance for Inflammatory Biomarkers in Routine Clinical Practice? World Neurosurgery, 104, 152-157.
- Shrot, S., Poretti, A., Tucker, E., Soares, B. et al. (2017). Acute brain injury following illicit drug abuse in adolescent and young adult patients: spectrum of neuroimaging findings. Neuroradiol J, 30, 144-150.
- Borne, J., Riascos, R., Cuellar, H., Vargas, D. y Rojas, R. (2005). Neuroimaging in drug and substance abuse part II: opioids and solvents. Top Magn Reson Imaging, 239-245.
- Dinicu, A. I., Chaudhari, A. y Kayyal, S. (2020). Diffuse subcortical white matter injury and bilateral basal ganglia neuronal loss after acute opioid overdose. Neuroradiol J, 33, 267-270.
- Tamrazi, B. y Almast, J. (2012). Your brain on drugs: imaging of drug-related changes in the central nervous system. Radiographics, 32, 701-719.