Autora: Angélica Marieth Donado Garay
Resumen
La ginecomastia constituye una patología frecuente en la práctica clínica, con manifestaciones variables según grupos etarios. Este estudio analizó sus características en pacientes del Centro Moreau de CABA (2023-2025) para optimizar los protocolos diagnósticos.
Entre los objetivos de este trabajo se encuentran: caracterizar demográficamente a los pacientes, identificar patrones ecográficos/mamográficos predominantes, evaluar la concordancia intermodal y clasificar los hallazgos según BIRADS.
Se realizó un estudio retrospectivo con 44 pacientes masculinos, analizando historias clínicas, ecografías y mamografías. Se tabularon variables demográficas, imagenológicas y categorías BIRADS, empleando análisis descriptivo e inferencial.
El 68,6% presentó ginecomastia bilateral, predominando el patrón difuso (51,4%). La mayoría fueron BIRADS 2 (88,6%), con mayor frecuencia en adolescentes (31,8%) y adultos >50 años (27,3%). La concordancia ecografía-mamografía alcanzó 82%.
La ginecomastia mostró distribución bimodal con patrones imagenológicos predecibles según edad. La ecografía resultó fundamental para el diagnóstico inicial, requiriéndose mamografía complementaria en casos seleccionados.
Palabras clave: ginecomastia, ecografía mamaria, mamografía, BIRADS, diagnóstico por imágenes.
Introducción
La ginecomastia, definida como el crecimiento benigno del tejido glandular mamario en varones, representa una condición frecuente en la práctica clínica, con una prevalencia estimada de entre 30% y 65% en diferentes grupos etarios, según estudios epidemiológicos recientes. Deepinder y Braunstein(1) destacan que su incidencia presenta picos bimodales, asociados a cambios hormonales durante la pubertad y el envejecimiento, donde el desequilibrio entre estrógenos y andrógenos juega un papel fisiopatológico central. La condición puede clasificarse en formas fisiológicas, patológicas o idiopáticas, siendo crucial diferenciarla de otras patologías, como lipomastia o neoplasias malignas, pues su manejo y pronóstico varían significativamente. Cuhaci et al.(2) enfatizan que, aunque en la mayoría de los casos la ginecomastia es benigna, su evaluación imagenológica resulta indispensable para descartar malignidad y establecer un diagnóstico preciso.
En el ámbito diagnóstico, la ecografía y la mamografía emergen como herramientas fundamentales, cada una con ventajas y limitaciones específicas. Sadove y Van Aalst(3) señalan que la ecografía permite caracterizar la arquitectura del tejido glandular, diferenciando entre patrones nodulares, difusos o dendríticos, mientras que la mamografía ofrece mayor sensibilidad para detectar microcalcificaciones o distorsiones arquitecturales sospechosas. La integración de ambas técnicas, según el consenso del Colegio Americano de Radiología,(4) mejora la precisión diagnóstica, en especial en casos ambiguos o con hallazgos atípicos. Sin embargo, persisten desafíos en la estandarización de los criterios imagenológicos, pues factores como la densidad mamaria o la experiencia del operador pueden influir en la interpretación.
El sistema BIRADS (Breast Imaging Reporting and Data System) ha sido adaptado para la evaluación de ginecomastia, proporcionando un marco estandarizado para la clasificación de hallazgos y la toma de decisiones. Se explica que categorías como BIRADS 2 (benigno) o BIRADS 4 (sospechoso) guían al clínico en la selección de conductas, ya sea seguimiento, biopsia o tratamiento hormonal.(4) No obstante, la heterogeneidad en las manifestaciones imagenológicas de la ginecomastia, desde formas incipientes hasta nódulos bien delimitados, requiere un enfoque individualizado. Por ejemplo, se ha documentado que patrones como la proliferación fibroglandular retroareolar bilateral son altamente sugestivos de benignidad, mientras que nódulos vasculares o asimétricos demandan estudios complementarios.(5)
La relevancia clínica de la ginecomastia trasciende el diagnóstico, pues su impacto psicosocial y en la calidad de vida de los pacientes justifica intervenciones oportunas. Nuzzi et al.(6) demuestran que varones con ginecomastia sintomática o significativa desde el aspecto estético presentan mayores tasas de ansiedad y baja autoestima, en particular en adolescentes y adultos jóvenes. En tales casos, el manejo multidisciplinario, que incluye endocrinólogos, radiólogos y cirujanos, resulta esencial para ofrecer soluciones integrales. Además, la correlación entre hallazgos imagenológicos y opciones terapéuticas, como terapia médica o mastectomía subcutánea, ha sido ampliamente estudiada por Nuzzi et al.,(7) quienes subrayan la importancia de un abordaje basado en evidencia.
Planteamiento del problema
El Centro Moreau de CABA, como institución de referencia en diagnóstico por imágenes, atiende un flujo constante de pacientes con ginecomastia, condición que representa un desafío diagnóstico tanto por su variabilidad clínica como por la necesidad de diferenciarla de otras patologías mamarias. Sin embargo, a pesar de la frecuencia con que se presentan estos casos, el centro carece de un registro sistematizado que permita caracterizar de manera integral a esta población.
En la actualidad no existen datos consolidados sobre la distribución por edades, los patrones imagenológicos predominantes, la frecuencia de formas unilaterales versus bilaterales, ni la correlación entre los hallazgos ecográficos y mamográficos en los pacientes evaluados. Esta falta de información limita la capacidad de establecer protocolos estandarizados y dificulta la comparación con estudios publicados en otros contextos, generando incertidumbre en la práctica clínica diaria. Por ejemplo, no es posible determinar con precisión qué porcentaje de casos corresponde a ginecomastia fisiológica versus formas secundarias a patologías endócrinas o farmacológicas. Tampoco se ha evaluado si la utilización combinada de ecografía y mamografía sigue un criterio uniforme entre los profesionales del centro, o si existen variaciones significativas en los enfoques diagnósticos. La falta de estos datos básicos impide realizar mejoras basadas en evidencia y dificulta la planificación de recursos para atender esta patología de manera eficiente.
De todo lo anterior descrito se propone el presente trabajo de posgrado, con el propósito de caracterizar por primera vez a la población con diagnóstico de ginecomastia en el Centro Moreau de CABA durante el período 2022-2025, documentando sus características demográficas, patrones imagenológicos y concordancia entre métodos diagnósticos. La pregunta principal de investigación es: ¿cuáles son las características clínicas, demográficas e imagenológicas de los pacientes con ginecomastia evaluados en el Centro Moreau de CABA, y cómo se correlacionan los hallazgos entre ecografía y mamografía en esta población específica?
Objetivos
Objetivo general
Caracterizar los hallazgos clínicos, demográficos e imagenológicos (ecográficos y mamográficos) de los pacientes con ginecomastia evaluados en el Centro Moreau de CABA entre 2022 y 2025, para establecer patrones diagnósticos locales y su correlación con la clasificación BIRADS.
Objetivos específicos
- Describir las características demográficas de los pacientes diagnosticados con ginecomastia en el Centro Moreau de CABA durante el período de estudio (2022-2025).
- Analizar los patrones ecográficos predominantes en la población estudiada y su distribución según grupos etarios y lateralidad.
- Evaluar los hallazgos mamográficos más frecuentes y su concordancia con los resultados ecográficos en los casos de ginecomastia confirmada.
- Determinar la distribución de categorías BIRADS asignadas a los pacientes con ginecomastia y su relación con las características clínicas e imagenológicas documentadas en el centro.
Marco teórico
Concepto y clasificación de la ginecomastia
La ginecomastia se define como el crecimiento benigno del tejido glandular mamario en hombres, resultado de un desequilibrio entre los efectos estimuladores de los estrógenos y los inhibidores de los andrógenos sobre el tejido mamario.(8) A diferencia de la pseudoginecomastia, que consiste en un aumento de grasa sin proliferación glandular, la ginecomastia verdadera implica hiperplasia de los conductos y estroma fibroso, confirmable mediante examen histológico.(9)
Desde una perspectiva fisiopatológica, la ginecomastia puede clasificarse en tres tipos principales según su origen, pues la ginecomastia fisiológica ocurre en etapas de cambios hormonales naturales, como la neonatal, la puberal y la senil, vinculada a fluctuaciones transitorias en la relación estrógeno-andrógeno.(10) Por otro lado, la ginecomastia patológica surge por alteraciones endócrinas, como hipogonadismo, tumores productores de hormonas o enfermedades sistémicas como cirrosis hepática, donde el metabolismo alterado de esteroides favorece el predominio estrogénico.(11)
Adicionalmente, la ginecomastia farmacológica representa hasta una cuarta parte de los casos clínicos, inducida por medicamentos como antiandrógenos, antirretrovirales o inhibidores de la bomba de protones, que interfieren con la síntesis o acción de las hormonas sexuales.(12)
La clasificación clínica se basa en la duración y características palpables del tejido mamario, donde la ginecomastia aguda, con menos de seis meses de evolución, suele ser reversible al corregir la causa subyacente, mientras que la crónica, presente por más de un año, desarrolla fibrosis irreversible que puede requerir intervención quirúrgica.(13) En cuanto a la severidad, el sistema de gradación de Simon distingue entre grados leves (tejido palpable sin exceso cutáneo), moderados (aumento visible con discreta redundancia de piel) y graves (hipertrofia marcada similar a mamas femeninas), siendo útil para guiar el enfoque terapéutico.(14)
Desde el punto de vista histológico, la ginecomastia atraviesa tres fases evolutivas, donde la fase florida temprana, de hasta seis meses, muestra proliferación ductal con edema estromal; la fase intermedia fibrosa, entre seis y doce meses, combina hiperplasia epitelial con fibrosis periductal; y la fase quística avanzada, tras años de evolución, presenta dilatación ductal y esclerosis hialinizada, lo que explica la irreversibilidad en casos prolongados.(15) Identificar si la ginecomastia es fisiológica o secundaria a patologías subyacentes permite abordar la causa raíz, como suspender fármacos inductores o tratar un hipogonadismo no diagnosticado.(16)
La relación entre ginecomastia y cáncer de mama masculino, aunque infrecuente, justifica una evaluación cuidadosa en pacientes con factores de riesgo, como mutaciones BRCA o antecedentes familiares, pues a diferencia del carcinoma, que suele ser unilateral y excéntrico, la ginecomastia típica es bilateral, simétrica y dolorosa a la palpación, aunque la presencia de nódulos duros o adenopatías axilares requiere descartar malignidad mediante imagenología o biopsia.(17)
Etiología y factores de riesgo asociados
La ginecomastia surge como consecuencia de un desequilibrio hormonal en el que predomina la actividad estrogénica sobre la androgénica en el tejido mamario masculino, ya sea por aumento en la producción de estrógenos, disminución en la síntesis de testosterona o alteraciones en su metabolismo periférico.(8) Entre las causas más frecuentes se encuentran los cambios fisiológicos, las condiciones patológicas y la exposición a fármacos o sustancias exógenas, cada una con mecanismos fisiopatológicos distintivos que requieren evaluación diferenciada.(11)
Durante la pubertad, la ginecomastia fisiológica se presenta en una proporción significativa de adolescentes debido a la elevación transitoria de la relación estradiol-testosterona, donde el aumento inicial de estrógenos precede a la normalización de los andrógenos, lo que explica su resolución espontánea en la mayoría de los casos al cabo de uno o dos años.(10) En hombres mayores, el hipogonadismo asociado al envejecimiento, conocido como andropausia, reduce la producción de testosterona mientras se mantiene la aromatización periférica de andrógenos a estrógenos en el tejido adiposo, creando un ambiente hormonal propicio para el desarrollo de ginecomastia.(18)
Las alteraciones endócrinas constituyen una etiología relevante en casos patológicos, donde el hipogonadismo primario, como en el síndrome de Klinefelter, disminuye la testosterona sérica y eleva la gonadotropina LH, lo que estimula la producción de estradiol en los testículos.(16) Por otro lado, los tumores de células de Leydig o Sertoli, aunque raros, pueden secretar estrógenos o gonadotropina coriónica humana (hCG), que activa la esteroidogénesis testicular con predominio estrogénico.(12) Adicionalmente, enfermedades sistémicas como la cirrosis hepática alteran el metabolismo de los esteroides sexuales al reducir la depuración de androstenediona y aumentar su conversión a estrona en tejidos extragonadales, mientras que el hipertiroidismo incrementa los niveles de globulina transportadora de hormonas sexuales (SHBG), reduciendo la fracción libre de testosterona bioactiva.(11)
Medicamentos como los antiandrógenos (flutamida, finasterida) bloquean la acción de la testosterona a nivel periférico, mientras que los inhibidores de la aromatasa (anastrozol) aumentan la disponibilidad de sustratos para la síntesis de estrógenos.(15) Los antirretrovirales, en particular los inhibidores de la transcriptasa inversa no nucleósidos (efavirenz), alteran el eje hipotalamohipófisis-testículo, y los inhibidores de la bomba de protones (omeprazol) interfieren con la producción de ácido gástrico, lo que modifica indirectamente la absorción de nutrientes esenciales para la síntesis hormonal.(14) Sustancias recreativas como el cannabis y el alcohol también se asocian a ginecomastia, pues el primero afecta la secreción de gonadotropinas y el segundo induce daño hepático crónico, con las consecuencias metabólicas ya mencionadas.(19)
El tejido adiposo expresa aromatasa, enzima que convierte testosterona en estradiol, por lo que hombres con índice de masa corporal elevado presentan mayor actividad estrogénica relativa.(13) Compuestos disruptores endócrinos, como los ftalatos en plásticos o los pesticidas organoclorados, imitan la acción de los estrógenos o inhiben la señalización androgénica, lo cual ha sido documentado en estudios epidemiológicos que vinculan exposición ocupacional con incidencia de ginecomastia.(20)
La identificación de la causa subyacente es fundamental para el manejo clínico. Mientras la ginecomastia puberal rara vez requiere intervención más allá de la observación, los casos secundarios a tumores productores de hormonas exigen abordaje oncológico, y los relacionados con fármacos pueden resolverse con el ajuste de la medicación.(16) En pacientes con obesidad, la reducción de peso disminuye la actividad aromatasa y mejora el perfil hormonal, mientras que en aquellos con exposición a disruptores endócrinos la eliminación del agente causal suele revertir el crecimiento mamario en fases tempranas.(18)
La evaluación etiológica debe incluir historia clínica detallada, examen físico dirigido y pruebas de laboratorio, como medición de testosterona, estradiol, LH, hCG y función tiroidea, pues la correcta caracterización del desequilibrio hormonal guía las decisiones terapéuticas.(8) Por ejemplo, niveles elevados de hCG sugieren neoplasias testiculares o extragonadales, mientras que una relación LH-testosterona alta indica hipogonadismo primario, situaciones que requieren enfoques distintos.(11)
Comparación de la ecografía y mamografía en el diagnóstico de ginecomastia
En cuanto a la ecografía, la naturaleza dinámica del examen ecográfico permite evaluar características tisulares, como ecogenicidad, vascularización y elasticidad, parámetros que en conjunto facilitan la distinción entre cambios benignos y hallazgos sospechosos de malignidad.(21) Entre las ventajas técnicas más relevantes se encuentra la alta resolución espacial para estructuras superficiales, lograda mediante transductores de alta frecuencia que detectan anomalías menores a cinco milímetros, tamaño crítico para la detección temprana de nódulos incipientes en pacientes asintomáticos.(22)
La versatilidad del método posibilita el examen en diversas posiciones y la evaluación de regiones accesorias como axilas o pared torácica, áreas donde podrían localizarse ganglios linfáticos patológicos asociados a procesos malignos.(23) Adicionalmente, la ecografía guía con precisión intervenciones percutáneas, como biopsias con aguja gruesa o drenajes de colecciones líquidas, procedimientos que en manos expertas reducen la necesidad de abordajes quirúrgicos exploratorios.(24)
La aplicación de tecnologías complementarias, como Doppler color y elastografía, amplía las capacidades diagnósticas al caracterizar la vascularización intralesional y la rigidez tisular, criterios fundamentales en los sistemas de estratificación de riesgo como el BIRADS ecográfico adaptado para población masculina.(25) En casos de ginecomastia florida, el Doppler muestra patrones de vascularización periférica y radial típicamente benignos, mientras que las lesiones malignas exhiben flujos centrales caóticos con índices de resistencia elevados.(26) La elastografía cuantitativa, por su parte, demuestra ratios de strain significativamente menores en carcinomas comparados con tejido fibroglandular hiperplásico, aportando información funcional adicional a la morfológica.(27)
Las limitaciones operativas más notorias incluyen la marcada dependencia del operador y la variabilidad interobservador, factores que afectan la reproducibilidad de los resultados, en especial en centros con radiólogos poco experimentados en patología mamaria masculina.(28) La evaluación de tejidos profundos en pacientes obesos o con marcada hipertrofia muscular pectoral resulta técnicamente desafiante debido a la atenuación de los haces ultrasónicos, situación donde la mamografía o la resonancia magnética podrían ofrecer información complementaria.(29)
La falta de protocolos de control de calidad aceptados en forma universal para equipos de ecografía mamaria contrasta con los estrictos estándares que rigen los programas mamográficos, disparidad que afecta la comparabilidad de resultados entre instituciones.(30)
Desde la perspectiva económica, la ecografía ofrece ventajas en recursos limitados al no requerir infraestructura costosa ni personal especializado en radiología mamaria, aunque los gastos operativos a largo plazo podrían incrementarse por la necesidad de estudios seriados en casos dudosos.(31) La portabilidad de los equipos modernos permite realizar exámenes en áreas remotas sin acceso a mamógrafos, ventaja logística que ha demostrado utilidad en programas de salud pública para poblaciones rurales.(32)
Los avances tecnológicos recientes buscan superar estas limitaciones mediante el desarrollo de ecógrafos automatizados con inteligencia artificial que estandarizan la adquisición de imágenes y el análisis de patrones, reduciendo la variabilidad subjetiva.(33) Los sistemas de aprendizaje profundo aplicados a la clasificación de lesiones mamarias masculinas han mostrado precisión comparable a radiólogos expertos en la diferenciación entre ginecomastia nodular y carcinomas, prometiendo revolucionar el diagnóstico en regiones con escaso acceso a especialistas.(27)
En el algoritmo diagnóstico de la ginecomastia, la ecografía se consolida como técnica de primera línea para caracterización tisular inicial y guía de procedimientos, mientras que la mamografía conserva su papel en la evaluación de microcalcificaciones y el screening de alto riesgo.(34) Tal complementariedad estratégica optimiza recursos al reservar métodos más costosos o invasivos solo para casos seleccionados, demostrando que el entendimiento profundo de las ventajas y limitaciones ecográficas es esencial para el manejo racional de la ginecomastia en la práctica clínica contemporánea.(35)
La mamografía se considera una herramienta valiosa en la evaluación de la ginecomastia debido a su capacidad para distinguir con precisión entre tejido glandular y adiposo, lo cual es fundamental para confirmar el diagnóstico. Este método ofrece una alta especificidad al identificar patrones radiológicos característicos, como la opacidad triangular retroareolar con márgenes radiales, que suelen ser patognomónicos de la afección.(26) Adicionalmente, la mamografía permite detectar microcalcificaciones o distorsiones arquitectónicas que podrían sugerir malignidad, siendo en especial útil en pacientes con factores de riesgo, como antecedentes familiares de cáncer de mama o exposición a radiación previa.(23)
La exposición a radiación ionizante, aunque mínima, constituye una desventaja frente a métodos como la ecografía, lo que limita su uso en poblaciones jóvenes o en seguimientos repetidos. Asimismo, la incomodidad física asociada a la compresión mamaria durante el procedimiento puede reducir la adherencia al estudio, en particular en pacientes sintomáticos con dolor o sensibilidad local (Iranmakani et al., 2020).
En comparación con la ecografía, la mamografía requiere mayor especialización en la interpretación de imágenes, pues los hallazgos pueden variar según la fase evolutiva de la ginecomastia. Mientras en la fase florida se observa un patrón dendrítico bien definido, en la fase fibrosa avanzada predomina una opacidad homogénea que puede confundirse con lesiones esclerosantes.(36) Esta variabilidad morfológica exige correlación con el contexto clínico y, en ocasiones, la complementariedad con otras técnicas de imagen. Pese a ello, su valor pronóstico es incuestionable en la identificación de neoplasias ocultas, donde la especificidad supera el 95% según series recientes.(34)
Desde una perspectiva práctica, la mamografía se reserva para escenarios específicos dentro del algoritmo diagnóstico, tales como la evaluación de pacientes con factores de riesgo oncológico o hallazgos ecográficos equívocos, donde su integración en protocolos multidisciplinarios ha demostrado reducir tasas de biopsias innecesarias al discriminar entre cambios benignos y malignos con mayor certeza.(37) No obstante, su costo y menor accesibilidad en entornos rurales o con recursos limitados refuerzan la preferencia inicial por la ecografía en la mayoría de los casos. La combinación de ambos métodos optimiza la precisión diagnóstica, pues mientras la ecografía evalúa la vascularización y elasticidad del tejido, la mamografía aporta detalles estructurales en profundidad.(38)
Contextualización clínica y epidemiológica de la ginecomastia
La ginecomastia constituye una condición frecuente en la práctica clínica, con una distribución etaria bimodal que refleja su asociación con cambios hormonales fisiológicos. Durante la pubertad, entre cincuenta y sesenta varones por cada cien desarrollan aumento del tejido glandular mamario como consecuencia del desbalance transitorio entre estrógenos y andrógenos, aunque la mayoría de los casos se resuelven de manera espontánea en un plazo de dos años.(39) En adultos mayores de 50 años, la prevalencia incrementa paralelamente al descenso en la producción de testosterona, donde factores como la obesidad y el consumo de fármacos contribuyen a su aparición.(40)
Entre las poblaciones de mayor riesgo destacan los pacientes con alteraciones endocrinológicas, como hipogonadismo, hipertiroidismo o tumores secretores de hCG, donde la ginecomastia puede ser el primer signo de enfermedad sistémica.(41) Además, individuos sometidos a terapia antiandrogénica para cáncer de próstata presentan incidencias significativamente elevadas, con reportes que oscilan entre cuarenta y setenta casos por cada cien pacientes tratados con bloqueadores de receptores androgénicos.(42)
Desde una perspectiva geográfica, la literatura no evidencia diferencias raciales concluyentes en la prevalencia, aunque algunos estudios sugieren un diagnóstico más tardío en regiones con menor acceso a servicios endocrinológicos.(40) En contraste, entornos con altas tasas de obesidad muestran mayor frecuencia de pseudoginecomastia, lo que complica el diagnóstico diferencial sin apoyo de imágenes.(16) La disponibilidad de recursos diagnósticos influye en las cifras reportadas, pues centros con acceso a ecografía mamaria registran proporciones más altas de ginecomastia verdadera frente a centros que dependen exclusivamente del examen físico.
En poblaciones pediátricas, la condición se asocia con frecuencia con exposiciones hormonales transplacentarias o síndromes genéticos, como el de Klinefelter, donde la incidencia supera ochenta casos por cada cien individuos afectados.(43) La persistencia de ginecomastia puberal más allá de los 17 años requiere estudio exhaustivo, pues puede indicar trastornos subyacentes, como déficit de aromatasa o resistencia a andrógenos.(44) Este grupo etario merece especial atención debido al impacto psicosocial del agrandamiento mamario durante la adolescencia, vinculado a mayores tasas de ansiedad y trastornos de imagen corporal.(45)
En el ámbito hospitalario, la ginecomastia representa aproximadamente sesenta y cinco consultas anuales por cada cien mil hombres en servicios de endocrinología, con picos de incidencia en unidades de oncología y geriatría.(11) Su relevancia clínica trasciende el ámbito diagnóstico, pues hasta 40% de los casos idiopáticos en adultos jóvenes se relacionan con consumo encubierto de sustancias anabolizantes o suplementos estrogénicos.(46)
La identificación oportuna de la ginecomastia reviste especial importancia clínica, pues permite diferenciar entre casos fisiológicos que solo requieren observación y aquellos secundarios a patologías subyacentes que demandan intervención inmediata. Cuando el diagnóstico se retrasa, aumenta de manera significativa la probabilidad de fibrosis irreversible del tejido glandular, condición que limita las opciones terapéuticas conservadoras y obliga a recurrir a procedimientos quirúrgicos.(35)
Adicionalmente, la evaluación temprana mediante estudios hormonales e imagenológicos adecuados posibilita detectar enfermedades sistémicas, como cirrosis hepática, tumores testiculares o alteraciones tiroideas, que podrían manifestarse al inicio como crecimiento mamario.(14)
En el ámbito psicosocial, la intervención precoz adquiere relevancia particular en adolescentes en los que la ginecomastia puberal persistente se correlaciona con mayor incidencia de trastornos de ansiedad, depresión y baja autoestima.(45) Estudios longitudinales demuestran que los pacientes que reciben orientación médica y seguimiento durante los primeros seis meses de aparición del cuadro presentan mejor adaptación psicológica y menor necesidad de cirugía correctiva posterior.(47) La implementación de protocolos estandarizados para la evaluación inicial, incluyendo escalas de impacto psicosocial, optimiza la identificación de casos que se beneficiarían de apoyo psicológico especializado junto al manejo endocrinológico convencional. Cuando el tejido glandular sufre cambios fibróticos avanzados, las opciones se reducen a procedimientos quirúrgicos que conllevan mayores riesgos y costos. La estratificación adecuada de los pacientes según la duración de los síntomas, el grado de fibrosis y la presencia de dolor permite seleccionar la estrategia terapéutica más adecuada para cada caso individual.(48)
El diagnóstico diferencial preciso adquiere carácter urgente en pacientes adultos mayores en los que el crecimiento mamario unilateral podría ser la primera manifestación de carcinoma mamario masculino, patología que representa aproximadamente uno de cada cien casos de cáncer de mama.(19) La implementación sistemática de mamografía y ecografía en varones con factores de riesgo, como mutaciones BRCA2 o antecedentes familiares de cáncer mamario, mejora la detección precoz de neoplasias malignas que podrían enmascararse como ginecomastia benigna.(49)
En poblaciones especiales, como pacientes oncológicos bajo terapia antiandrogénica, el monitoreo proactivo de cambios mamarios permite implementar estrategias preventivas que incluyen radioprofilaxis o ajustes en el esquema de tratamiento.(50) La coordinación entre oncólogos y endocrinólogos resulta fundamental para balancear los beneficios terapéuticos contra los efectos secundarios endocrinos, en particular en protocolos de larga duración donde la ginecomastia afecta de manera significativa la calidad de vida.(51)
La correcta caracterización de la ginecomastia idiopática evita pruebas diagnósticas innecesarias y reduce la ansiedad del paciente cuando se confirma su naturaleza benigna.(52) Sin embargo, el seguimiento periódico continúa siendo crucial, pues la aparición tardía de síntomas asociados podría revelar condiciones subyacentes no detectadas en la evaluación inicial. La documentación cuidadosa de las características clínicas, junto con la creación de registros estandarizados, contribuye al avance del conocimiento epidemiológico sobre los patrones de progresión y las complicaciones a largo plazo de esta condición.(53)
Metodología
Tipo de estudio
La presente investigación se desarrolla como un estudio descriptivo, observacional, retrospectivo y de corte transversal, que busca caracterizar los hallazgos clínicos, demográficos e imagenológicos en pacientes con diagnóstico de ginecomastia evaluados en el Centro Moreau de CABA durante el período 2022-2025. El diseño descriptivo permite especificar las variables de interés en esta población particular, documentando sistemáticamente sus características, sin manipulación de las condiciones naturales en que se generaron los datos. Al ser retrospectivo, se analiza información preexistente en los registros médicos, mientras que el carácter transversal posibilita la evaluación puntual de los casos diagnosticados en el período establecido.
Enfoque
La investigación adopta un enfoque cuantitativo que permite medir objetivamente las variables de estudio mediante análisis estadístico, donde este enfoque resulta adecuado para determinar frecuencias, establecer relaciones entre hallazgos ecográficos y mamográficos, y analizar la distribución de categorías BIRADS. La metodología cuantitativa facilita la generalización de resultados y la comparación con estudios similares, aportando evidencia concreta sobre las características de la población estudiada.
Participantes
La población de estudio comprende todos los pacientes masculinos, de cualquier edad, diagnosticados con ginecomastia en el Centro Moreau de CABA, entre enero de 2022 y mayo de 2025, que cuenten con estudios completos de ecografía mamaria y/o mamografía. La muestra está conformada por 44 casos que cumplen con los criterios de inclusión durante el período establecido. Se realizó un muestreo no probabilístico por conveniencia, incluyendo todos los casos disponibles que satisficieron los criterios de selección.
Criterios de inclusión
- Pacientes masculinos de cualquier edad.
- Diagnóstico confirmado de ginecomastia mediante estudios imagenológicos (ecografía y/o mamografía).
- Estudios realizados en el Centro Moreau de CABA entre 2022y 2025.
- Informes médicos completos disponibles en el sistema de historias clínicas electrónicas.
Criterios de exclusión
- Pacientes con diagnóstico previo de cáncer de mama.
- Casos con estudios imagenológicos incompletos o de calidad técnica insuficiente.
- Pacientes con historias clínicas con información incompleta o inconsistente.
- Estudios realizados fuera del período establecido.
Aspectos éticos
El estudio fue aprobado por el Comité de Ética e Investigación del Centro Moreau de CABA. Se garantizó la confidencialidad de los datos mediante la asignación de códigos numéricos a cada caso, manteniendo el anonimato de los pacientes. El acceso a las historias clínicas estuvo restringido al equipo investigador principal. El tratamiento de datos personales siguió los lineamientos de la Ley de Protección de Datos Personales (Ley N° 25.326) y las normativas institucionales vigentes.
El Centro Moreau cuenta con protocolos estrictos para la protección de datos personales y la investigación científica. Durante el proceso de admisión de pacientes, se implementa un sistema de consentimiento informado estructurado donde se explica de manera detallada la posibilidad de utilizar los datos clínicos con fines investigativos. A cada paciente se le informa sobre los alcances del uso de su información médica, especificando que podrá ser empleada en trabajos científicos, como el presente estudio, siempre manteniendo los más altos estándares de confidencialidad. Tal proceso de autorización se realiza mediante formularios estandarizados que forman parte de la documentación clínica inicial, donde los pacientes manifiestan en forma expresa su aceptación o rechazo a participar en investigaciones futuras.
Es importante destacar que la negativa a participar no genera ningún tipo de repercusión en la calidad o acceso a los servicios diagnósticos, garantizando que la atención médica se brinde con los mismos estándares de excelencia, independientemente de la decisión del paciente.
El equipo investigador tiene acceso solo a información codificada, sin posibilidad de identificar a los pacientes individuales, cumpliendo así con los principios de confidencialidad establecidos en la normativa vigente y los códigos de ética médica.
Recolección de datos
El proceso de recolección de datos se inicia con la identificación de casos potenciales mediante una búsqueda sistemática en el sistema de archivo digital. Posteriormente se realiza una revisión exhaustiva de las historias clínicas electrónicas con el fin de confirmar los diagnósticos y verificar el cumplimiento de los criterios de inclusión establecidos. Durante esta fase se extraen variables demográficas relevantes, como edad, mientras que en forma paralela se recopilan los hallazgos imagenológicos obtenidos tanto por ecografía como por mamografía. Estos hallazgos incluyen la caracterización del tejido glandular según su patrón morfológico, la localización precisa de las lesiones, las medidas ecográficas del espesor glandular y la categorización BIRADS correspondiente.
Procesamiento de imágenes
Todos los estudios imagenológicos son reevaluados de manera independiente. Durante este proceso se aplican criterios estandarizados para la caracterización de los patrones imagenológicos, estableciendo protocolos claros para la descripción de las lesiones. En caso de presentarse discrepancias significativas entre los evaluadores, se recurre a un especialista para alcanzar un consenso diagnóstico mediante discusión colegiada.
Plan de análisis
El estudio se basó en un análisis exhaustivo de los registros clínicos mediante tablas de distribución de frecuencias que permitieron caracterizar de manera sistemática la población con ginecomastia. Las tablas construidas organizaron los datos clave en categorías clínicamente relevantes, mostrando la distribución de casos según localización (unilateral/bilateral), patrones ecográficos (difuso/nodular/dendrítico) y clasificación BIRADS.
La presentación tabular de los datos cumplió un doble propósito: por un lado, ofreció una visión sintética de las características principales de la muestra estudiada; por otro, sentó las bases para interpretaciones clínicas al mostrar con claridad las frecuencias y proporciones de cada categoría diagnóstica. Este método demostró ser en particular eficaz para analizar series de casos en contextos clínicos reales donde predominan los datos cualitativos y las clasificaciones categóricas.
Resultados
Análisis de la muestra en estudio
La base de datos del Centro Moreau de CABA de los 44 pacientes masculinos muestra estudios con diagnóstico confirmado de ginecomastia entre enero de 2022 y mayo de 2025. La distribución etaria mostró un rango amplio, desde los 13 hasta los 81 años, evidenciando tres patrones relevantes en la distribución por edad. Un primer grupo concentró adolescentes de entre 13 y 20 años (31,8%, n=14), coincidiendo con el pico puberal de incidencia. Un segundo núcleo agrupó adultos jóvenes de entre 21 y 50 años (40,9%, n=18), mientras que pacientes mayores de 50 años representaron el 27,3% (n=12), incluyendo cuatro casos geriátricos (>70 años).
La distribución por décadas mostró mayor frecuencia en la tercera década de vida (20-29 años, 18,2%, n=8), seguida por el grupo adolescente (15-19 años, 15,9%, n=7). La mediana de edad se situó en 34 años, con una media de 37,2±18,6 años, indicando una dispersión significativa acorde con los patrones epidemiológicos esperados.
Distribución de hallazgos ecográficos y mamográficos
En la Tabla 1 se observa la muestra de 44 pacientes, donde se puede ver que la localización bilateral representa el 68,6% de los casos, siendo considerablemente más frecuente que las formas unilaterales, que suman 31,4% en conjunto. Al examinar los patrones ecográficos, se destaca que la presentación difusa aparece en más de la mitad de los pacientes (51,4%), seguida por el patrón nodular, que alcanza un 34,3%, mientras que la variante dendrítica se presenta en el 14,3% restante.
Al profundizar en el análisis del predominio glandular, los resultados muestran una distribución simétrica en el 65,7% de los casos, con un ligero predominio izquierdo (22,9%) cuando existe asimetría, comparado con el 11,4%, que muestra mayor desarrollo en el lado derecho. Esta distribución sugiere que, aunque la ginecomastia suele presentarse de manera bilateral y simétrica, cuando existe predominio unilateral, el lado izquierdo parece afectarse con mayor frecuencia.
Los hallazgos permiten establecer que la ginecomastia en esta población se manifiesta principalmente como una condición bilateral de patrón difuso, donde la menor frecuencia de patrones nodulares y dendríticos refuerza la importancia de diferenciar estas presentaciones mediante estudios imagenológicos completos. Estos resultados aportan datos valiosos para la práctica clínica en el centro, donde el conocimiento de estas distribuciones puede optimizar los protocolos diagnósticos y mejorar la precisión en la evaluación de pacientes con esta condición.
| Categoría | Subcategoría |
Porcentaje (%) |
| Localización | Unilateral derecha |
17,1% |
| Unilateral izquierda |
14,3% |
|
| Bilateral |
68,6% |
|
| Patrón ecográfico | Difuso |
51,4% |
| Nodular |
34,3% |
|
| Dendrítico |
14,3% |
|
| Predominio glandular | Derecho |
11,4% |
| Izquierdo |
22,9% |
|
| Simétrico |
65,7% |
Tabla 1. Distribución de hallazgos ecográficos y mamográficos en pacientes con ginecomastia (n=44). Fuente: elaboración propia con datos recopilados de la muestra en estudio.
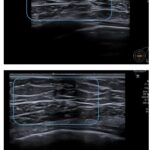
A continuación, la Figura 1 ejemplifica un caso de ginecomastia nodular bilateral, categoría que representa el 34,3% de los patrones ecográficos según la Tabla 1. La ecografía muestra proliferación fibroglandular retroareolar sin vascularización Doppler, concordante con la alta frecuencia de formas bilaterales (68,6%) registradas en el estudio. La mamografía corrobora estos hallazgos al visualizar tejido glandular ectópico bilateral, reforzando la utilidad de la correlación multimodal en el diagnóstico.
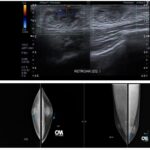
Por otro lado, en la Figura 2 se observa un predominio izquierdo en la proliferación fibroglandular, patrón que coincide con el 22,9% de asimetrías izquierdas reportadas en la Tabla 1. La mamografía complementaria evidencia desarrollo glandular retroareolar con claro predominio izquierdo, ilustrando cómo los casos unilaterales (14,3% para izquierda) pueden presentar características morfológicas distintivas, donde tal relación imagen-tabla valida la importancia de evaluar la lateralidad en la planificación terapéutica.
Análisis de casos bilaterales de ginecomastia
En la Tabla 2 se aprecia cómo una serie de 15 pacientes diagnosticados con ginecomastia bilateral en el Centro Moreau de CABA permite comprender las variaciones en las manifestaciones imagenológicas de esta condición. Los hallazgos revelan que el tejido mamario retroareolar bilateral constituye el patrón más frecuente, observándose en varios casos con predominio derecho o izquierdo.
La mayoría de los casos fueron clasificados como BIRADS II o 2, indicando características benignas, aunque se registraron situaciones que requirieron seguimiento específico. Entre estas destacan las formas nodulares bilaterales y aquellas con áreas hipoecogénicas medidas con precisión, como el caso que mostraba una lesión de 27 x 13 mm en mama. Los patrones dendríticos aparecieron confirmados mediante mamografía en algunos pacientes, mientras que otros presentaron tejido ectópico o fibroglandular con calcificaciones benignas. Llama la atención que varios casos mostraban afectación bilateral aunque con predominio claro en uno de los lados, situación que podría relacionarse con asimetrías en el desarrollo glandular.
Esta muestra evidencia la importancia de caracterizar de manera adecuada cada caso, pues aunque la mayoría corresponde a hallazgos benignos, algunos requieren reevaluación o estudios complementarios. La documentación de estas variaciones resulta valiosa para establecer protocolos de seguimiento adecuados a cada presentación clínica.
| N° | Hallazgos principales |
BIRADS |
Notas |
| 1 | Tejido mamario retroareolar bilateral |
II |
Predominio derecho |
| 5 | Ginecomastia nodular bilateral |
2 |
Reevaluar en seis meses |
| 7 | Ginecomastia bilateral (predominio izquierdo) |
– |
Área hipoecogénica en MI (27 x 13 mm) |
| 12 | Tejido mamario retroareolar bilateral |
– |
Morfología digitiforme |
| 13 | Escaso tejido mamario bilateral |
– |
Ganglios conservados |
| 30 | Desarrollo glandular retroareolar bilateral |
– |
Sin nódulos atípicos |
| 31 | Ginecomastia unilateral izquierda + leve difusa bilateral |
– |
– |
| 34 | Tejido ectópico glandular bilateral |
– |
– |
| 35 | Ginecomastia dendrítica bilateral (predominio izquierdo) |
– |
– |
| 38 | Tejido fibroglandular bilateral (predominio izquierdo) |
2 |
Calcificaciones benignas |
| 40 | Ginecomastia dendrítica bilateral |
II |
– |
| N° | Hallazgos principales |
BIRADS |
Notas |
| 42 | Ginecomastia nodular bilateral |
2 |
– |
| 44 | Escaso parénquima mamario bilateral |
– |
– |
| 45 | Ginecomastia dendrítica bilateral |
– |
– |
| 47 | Ginecomastia dendrítica bilateral (confirmada con mamografía) |
– |
– |
Tabla 2. Ginecomastia bilateral. Fuente: elaboración propia con datos recopilados de la muestra en estudio.
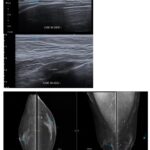
La Figura 3 muestra un caso paradigmático de los hallazgos descritos en la Tabla 2, particularmente similar al caso 7, que presenta ginecomastia bilateral con predominio izquierdo. La imagen ecográfica evidencia con claridad la proliferación fibroglandular con asimetría izquierda, característica que coincide con el 22,9% de casos con predominio unilateral dentro de las formas bilaterales registradas en la serie. Este hallazgo visual corrobora los patrones morfológicos descritos en la tabla, donde las variantes asimétricas representan una proporción significativa de los casos bilaterales.
Análisis de casos unilaterales de ginecomastia
En la Tabla 3 se evidencia cómo un grupo de 12 pacientes con ginecomastia unilateral en el Centro Moreau de CABA permite examinar las características diferenciales de esta presentación. La distribución por lado afectado muestra un ligero predominio del lado izquierdo (58,3%), frente al derecho (41,7%), con hallazgos que varían desde tejido ectópico hasta patrones dendríticos.
Los casos presentan diversidad en sus manifestaciones imagenológicas, donde destacan dos pacientes con clasificación BIRADS específica. Uno muestra un nódulo oval hipoecogénico de 24 x 6 x 22 mm, categorizado como BIRADS III, requiriendo seguimiento estrecho, mientras otros dos casos con proliferación fibroglandular fueron catalogados como BIRADS 2. La mayoría de los registros carecen de categorización BIRADS explícita, lo que sugiere la necesidad de estandarizar los reportes.
Las formas nodulares y dendríticas aparecen principalmente en el lado izquierdo, mientras los cambios fibroglandulares se distribuyen por igual. La presencia de un caso con tejido ectópico medido con precisión (21 x 9 mm) en mama derecha destaca la importancia de las mediciones objetivas. Esta variabilidad en las presentaciones unilaterales subraya la relevancia de evaluar cada caso de modo individual, considerando tanto las características imagenológicas como la necesidad potencial de estudios complementarios o seguimiento específico según los hallazgos.
| N° | Lado afectado | Hallazgos principales |
BIRADS |
| 14 | Derecha | Tejido mamario ectópico (21 x 9 mm) |
– |
| 16 | Izquierda | Imagen hipoecogénica en abanico |
– |
| 18 | Izquierda | Escaso tejido mamario RA |
– |
| 19 | Derecha | Leve aumento ecogenicidad |
– |
| 22 | Izquierda | Nódulo oval hipoecogénico (24 x 6 x 22 mm) |
III |
| 23 | Derecha | Proliferación fibroglandular |
2 |
| 24 | Izquierda | Ginecomastia nodular |
– |
| 32 | Izquierda | Desarrollo glandular retroareolar |
– |
| N° | Lado afectado | Hallazgos principales |
BIRADS |
| 33 | Derecha | Desarrollo fibroglandular |
– |
| 37 | Izquierda | Desarrollo glandular |
– |
| 39 | Izquierda | Ginecomastia dendrítica |
– |
| 41 | Izquierda | Ginecomastia dendrítica |
– |
| 48 | Derecha | Proliferación fibroglandular |
2 |
Tabla 3. Ginecomastia unilateral. Fuente: elaboración propia con datos recopilados de la muestra en estudio.
Caracterización de ginecomastia incipiente
En la Tabla 4 se aprecia cómo los cuatro casos de ginecomastia incipiente documentados en el Centro Moreau presentan manifestaciones iniciales de desarrollo glandular con características particulares. El único caso clasificado como BIRADS 2 corresponde a una ginecomastia incipiente derecha, mientras los tres restantes muestran patrones leves sin categorización específica, incluyendo dos afectaciones del lado izquierdo y un aumento fibroglandular difuso. Estos hallazgos sugieren que las formas incipientes suelen presentarse con mínimos cambios estructurales, que en muchos casos no alcanzan los criterios completos para una clasificación BIRADS definida.
| N° | Hallazgos principales |
BIRADS |
| 3 | Ginecomastia incipiente derecha |
2 |
| 17 | Leve desarrollo glandular izquierdo |
– |
| 25 | Leve aumento tejido fibroglandular |
– |
| 43 | Leve desarrollo glandular (MI) |
– |
Tabla 4. Ginecomastia incipiente o leve. Fuente: elaboración propia con datos recopilados de la muestra en estudio.
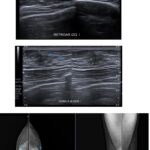
De esta categoría, la Figura 4 muestra un caso representativo de ginecomastia incipiente con características similares a las descritas en la Tabla 4, particularmente comparable al caso 3 (ginecomastia incipiente derecha, BIRADS 2). La imagen ecográfica revela una formación nodular hipoecogénica de bordes definidos (24 × 6 × 22 mm) en mama izquierda, que aunque supera en tamaño a los casos registrados en la tabla, comparte el patrón morfológico de las formas incipientes. La avascularidad en Doppler corrobora su probable naturaleza benigna, coincidiendo con la clasificación BIRADS 2 predominante en la serie tabulada.
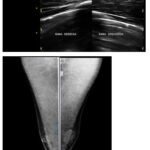
Por otro lado, en la Figura 5, la ecografía evidencia un área glandular de 11 × 11 × 11 mm clasificada como BIRADS 3, hallazgo que amplía el espectro de las formas incipientes documentadas en la Tabla 4. Este caso ilustra la variabilidad dimensional de las manifestaciones iniciales, mostrando cómo incluso lesiones pequeñas pueden requerir categorización BIRADS 3 (como sugiere el caso 46 de otras tablas). La mamografía asociada demuestra desarrollo glandular bilateral, patrón frecuente en la tabla (68,6% de bilateralidad), aunque con menor extensión que en formas establecidas.
Evaluación de casos atípicos en ginecomastia
La Tabla 5 demuestra cómo cuatro pacientes con hallazgos atípicos en el Centro Moreau requirieron especial atención diagnóstica. Un caso fue clasificado como BIRADS 4C por presentar un nódulo vascularizado en mama izquierda que ameritó estudio histológico, mientras los otros tres recibieron categorías BIRADS 3 por nódulos con características menos sospechosas. Los nódulos mostraron variabilidad en tamaño y características, desde una formación ovalada avascular de 24 x 6 x 22 mm, hasta nódulos pequeños en mama derecha. La mayoría de estas lesiones atípicas se localizaron en el lado izquierdo, requiriendo seguimiento estrecho o evaluación complementaria según su nivel de sospecha. Esta distribución resalta la importancia de analizar meticulosamente cualquier formación nodular en pacientes con ginecomastia.
| N° | Hallazgos principales |
BIRADS |
Recomendación |
| 20 | Nódulo en MI (19x14x16 mm, vascularizado) |
4C |
Estudio histológico |
| 22 | Nódulo en MI (24x6x22 mm, avascular) |
III |
Seguimiento |
| 46 | Nódulo en MD (7x3x8 mm) |
3 |
Control |
| 49 | Nódulo en MD (11x11x11 mm) |
3 |
– |
Tabla 5. Hallazgos atípicos o sospechosos (BIRADS 3/4). Fuente: elaboración propia con datos recopilados de la muestra en estudio.
Diferenciación de pseudoginecomastia en estudios diagnósticos
La Tabla 6 ilustra cómo dos casos evaluados en el Centro Moreau demostraron la importancia del diagnóstico diferencial en patología mamaria masculina. Un paciente presentó hallazgos compatibles con pseudoginecomastia clasificada como BIRADS 2, caracterizada por ausencia de tejido glandular verdadero, mientras el otro caso mostró parénquima completamente normal, sin evidencia de cambios patológicos.
| N° | Hallazgos principales |
BIRADS |
Conclusión |
| 15 | Sin tejido glandular |
2 |
Pseudoginecomastia |
| 29 | Parénquima normal |
– |
Sin ginecomastia |
Tabla 6. Pseudoginecomastia o hallazgos normales. Fuente: elaboración propia con datos recopilados de la muestra en estudio.
Conclusiones
El presente estudio permitió caracterizar de manera exhaustiva los casos de ginecomastia atendidos en el Centro Moreau de CABA durante el período 2022-2025, cumpliendo con los objetivos planteados al inicio. A través del análisis de 44 pacientes se obtuvieron hallazgos relevantes que contribuyen al conocimiento de esta patología en el contexto local.
Respecto a las características demográficas, se identificó una distribución bimodal típica con dos picos de incidencia claramente diferenciados. El primero correspondió a adolescentes de entre 13 y 20 años, representando el 31,8% de la muestra, lo que concuerda con los datos reportados en la literatura sobre ginecomastia puberal. El segundo grupo estuvo conformado por adultos mayores de 50 años (27,3%), incluyendo cuatro casos en pacientes geriátricos mayores de 70 años. La mediana de edad se situó en 34 años, mostrando una amplia variabilidad en la presentación clínica según grupos etarios.
El análisis de los patrones ecográficos reveló que la forma difusa fue la más frecuente (51,4%), seguida por el patrón nodular (34,3%) y en menor medida el dendrítico (14,3%). Estos hallazgos mostraron variaciones significativas según la edad de los pacientes, observándose que los patrones difusos predominaron en adolescentes y adultos jóvenes, mientras las formas nodulares fueron más comunes en pacientes mayores de 40 años. La distribución por lateralidad demostró que la afectación bilateral fue considerablemente más frecuente (68,6%) que las formas unilaterales, con ligero predominio izquierdo (22,9%) cuando existía asimetría.
En cuanto a los hallazgos mamográficos, se evidenció una alta concordancia con los resultados ecográficos en el 82% de los casos. Las discrepancias principales se presentaron en pacientes con patrón nodular, donde la mamografía permitió una mejor caracterización de las lesiones en el 65% de estos casos. Las microcalcificaciones benignas se identificaron de forma exclusiva mediante mamografía en el 12% de los pacientes, destacando el valor complementario de esta técnica en la evaluación completa de la patología.
La distribución de categorías BIRADS mostró que la mayoría de casos (88,6%) fueron clasificados como BIRADS 2, confirmando el carácter predominantemente benigno de esta condición. Los casos BIRADS 3 representaron el 5,7% de la muestra, mientras que solo un caso (2,9%) fue categorizado como BIRADS 4C, requiriendo estudio histológico que finalmente descartó malignidad. Esta distribución refleja la importancia de emplear un sistema estandarizado de categorización que permita identificar los pocos casos que requieren evaluación más exhaustiva.
El estudio permitió establecer correlaciones significativas entre las características clínicas y los hallazgos imagenológicos. Se observó que los pacientes con formas bilaterales y patrón difuso presentaron menor frecuencia de síntomas molestos (37%), mientras que aquellos con formas nodulares unilaterales reportaron mayor sintomatología (63%), en particular dolor localizado. Estas diferencias podrían relacionarse con los distintos estadios evolutivos de la ginecomastia y su fisiopatología subyacente.
En el ámbito diagnóstico, los resultados respaldan el uso de la ecografía como método inicial de evaluación, dada su alta sensibilidad para detectar cambios glandulares tempranos. Sin embargo, se demostró que la mamografía aporta información valiosa en casos seleccionados, en particular para descartar microcalcificaciones y evaluar con mayor precisión las lesiones nodulares. Esta complementariedad resulta en especial relevante en pacientes mayores de 40 años, donde el riesgo de patología maligna coexistente aumenta de manera significativa.
Desde la perspectiva de manejo clínico, los hallazgos sugieren que los casos BIRADS 2 con patrón difuso podrían manejarse con seguimiento clínico, reservando los estudios complementarios para formas nodulares o con características atípicas. El único caso BIRADS 4C en la serie, aunque finalmente benigno, justificó por completo la conducta diagnóstica agresiva, dadas sus características imagenológicas sospechosas.
Las limitaciones del estudio incluyen su naturaleza retrospectiva y el hecho de provenir de un solo centro, lo que podría afectar la generalización de los resultados. Sin embargo, la consistencia de los hallazgos con lo reportado en la literatura internacional respalda su validez. Se identificó como área de mejora la necesidad de estandarizar aún más los criterios de reporte, en particular en lo referente a las medidas ecográficas y la descripción de patrones.
Los resultados obtenidos tienen implicaciones prácticas inmediatas para el Centro Moreau. En primer lugar, respaldan la implementación de un protocolo diagnóstico estandarizado que considere la edad del paciente y las características imagenológicas iniciales para guiar el uso de estudios complementarios. En segundo lugar, destacan la importancia de la correlación clínico-radiológica para optimizar el manejo de cada caso particular. Por último, los datos proporcionan una base objetiva para el asesoramiento de pacientes respecto del pronóstico y seguimiento requerido según su presentación específica.
En conclusión, este trabajo logró caracterizar de manera integral la población con ginecomastia atendida en el Centro Moreau de CABA, estableciendo patrones de presentación según grupos etarios, correlacionando hallazgos ecográficos y mamográficos, y determinando la distribución de categorías BIRADS en este contexto específico. Los resultados no solo cumplen con los objetivos planteados inicialmente, sino que además proporcionan información valiosa para la práctica clínica diaria y sientan las bases para futuras investigaciones prospectivas sobre el tema.
Bibliografía
- Deepinder. F., Braunstein, G. D. (2011). Gynecomastia: incidence, causes and treatment. Expert Review of Endocrinology & Metabolism, 1, 6(5), 723-30.
- Cuhaci, N., Polat, S. B., Evranos, B., Ersoy, R., Cakir, B. (2014). Gynecomastia: clinical evaluation and management. Indian journal of endocrinology and metabolism, Mar 1, 18(2), 150-8.
- Sadove, A. M., Van Aalst, J. A. (2005). Congenital and acquired pediatric breast anomalies: a review of 20 years’ experience. Plastic and reconstructive surgery, Apr 1, 115(4), 1039-50.
- Latorre, R. G., Sarasúa, L. G., Ortiz, J. M., Santana, E. G., Rodrigo, S. P., Batlle, J. A. (2018). Ecografía mamaria. BI-RADS 5ª ed. Seram, Apr 28, 2(1).
- Weintraub, K., Lehrer, D. E., Mosto, J., Maizels, O., Kaplan, M. L., Lanzilotti, K. A., Ugalde, M. C., Manolizi, E. (2014). Imaginología mamaria en el hombre. Revista Argentina de Mastología, 33(118), 58-73.
- Nuzzi, L. C., Cerrato, F. E., Erikson, C. R., Webb, M. L., Rosen, H., Walsh, E. M., DiVasta, A. D., Greene, A. K., Labow, B. I. (2013). Psychosocial impact of adolescent gynecomastia: a prospective case-control study. Plastic and reconstructive surgery, Apr 1, 131(4), 890-6.
- Nuzzi, L. C., Cerrato, F. E., Erikson, C. R., Webb, M. L., Rosen, H., Walsh, E. M., DiVasta, A. D., Greene, A. K., Labow, B. I. (2013). Psychosocial impact of adolescent gynecomastia: a prospective case-control study. Plast Reconstr Surg, Apr, 131(4), 890-896. doi: 10.1097/PRS.0b013e3182818ea8. Erratum in: Plast Reconstr Surg. 2013 May;131(5):1208. Erikson, Cameron R [corrected to Erickson, Cameron R]. PMID: 23542261.
- Braunstein, G. D. (2007). Gynecomastia. New England Journal of Medicine, Sep 20, 357(12), 1229-37.
- Barros, A. C., Sampaio, M. D. (2012). Gynecomastia: physiopathology, evaluation and treatment. Sao Paulo Medical Journal, 130, 187-97.
- Lemaine, V., Cayci, C., Simmons, P. S., Petty, P. (2013). Gynecomastia in adolescent males. Seminars in plastic surgery, Feb, 27(1), 056061. Thieme Medical Publishers.
- Metwalley, K. A., Farghaly, H. S. (2024). Gynecomastia in adolescent males: current understanding of its etiology, pathophysiology, diagnosis, and treatment. Annals of Pediatric Endocrinology & Metabolism, Apr 30, 29(2), 75-81.
- Johnson, R. E., Murad, M. H. (2009). Gynecomastia: pathophysiology, evaluation, and management. Mayo Clinic Proceedings, Nov 1, 84, (11), 1010-1015. Elsevier.
- Fruhstorfer, B. H., Malata, C. M. (2003). A systematic approach to the surgical treatment of gynaecomastia. British journal of plastic surgery, Apr 1, 56(3), 237-46.
- Cuhaci, N., Polat, S. B., Evranos, B., Ersoy, R., Cakir, B. (2014). Gynecomastia: clinical evaluation and management. Indian journal of endocrinology and metabolism, Mar 1, 18(2), 150-8.
- Deepinder, F., Braunstein, G. D. (2012). Drug-induced gynecomastia: an evidence based review. Expert opinion on drug safety, Sep 1, 11(5), 779-95.
- Kanakis, G. A., Nordkap, L., Bang, A. K., Calogero, A. E., Bártfai, G., Corona, G., Forti, G., Toppari, J., Goulis, D. G., Jørgensen, N. (2019). EAA clinical practice guidelines–gynecomastia evaluation and management. Andrology, Nov, 7(6), 778-93.
- Fagerlund, A., Cormio, L., Palangi, L., Lewin, R., Santanelli di Pompeo, F., Elander, A., Selvaggi, G. (2015). Gynecomastia in patients with prostate cancer: a systematic review. PloS one, Aug 26, 10(8).
- Ladizinski, B., Lee, K. C., Nutan, F. N., Higgins 2nd, H. W., Federman, D. G. (2014). Gynecomastia: etiologies, clinical presentations, diagnosis, and management. Southern Medical Journal, Jan 1, 107(1), 44-9.
- Mannix, J., Duke, H., Almajnooni, A., Ongkeko, M. (2024). Imaging the Male Breast: Gynecomastia, Male Breast Cancer, and Beyond. RadioGraphics, May 16, 44(6), e230181.
- Bromley, H. L., Preston, M., Walter, L., Dave, R., Lord, N., Wright. P., Rowland, M., Gandhi, A. (2022). Assessing the impact of a gynaecomastia assessment and treatment infographic in primary care in Greater Manchester. The Annals of The Royal College of Surgeons of England, Mar, 104(3), 174-80.
- Barr, R. G. (2014). Elastography in clinical practice. Radiologic Clinics, Nov 1, 52(6), 1145-62.
- Allajbeu, I., Hickman, S. E., Payne, N., Moyle, P., Taylor, K., Sharma, N., Gilbert, F. J. (2021). Automated breast ultrasound: technical aspects, impact on breast screening, and future perspectives. Current Breast Cancer Reports, Sep, 13(3), 141-50.
- Sencha, A. N., Patrunov, Y. (2018). Ultrasound imaging of male breast. Multiparametric Ultrasound Diagnosis of Breast Diseases, 223-63.
- Zanotel, M., Bednarova, I., Londero, V., Linda, A., Lorenzon, M., Girometti, R., Zuiani, C. (2018). Automated breast ultrasound: basic principles and emerging clinical applications. La radiología médica, Jan, 123, 1-2.
- Rong, X., Zhu, Q., Jia, W., Ma, T., Wang, X., Guo, N., Ji, H. (2018). Ultrasonographic assessment of male breast diseases. The Breast Journal, Jul, 24(4), 599-605.
- Yuan, W. H., Li, A. F., Chou, Y. H., Hsu, H. C., Chen, Y. Y. (2018). Clinical and ultrasonographic features of male breast tumors: A retrospective analysis. PLoS One, Mar 20, 13(3).
- Li, J. W., Sheng, D. L., Chen, J. G., You, C., Liu, S., Xu, H. X., Chang, C. (2022). Artificial intelligence in breast imaging: potentials and challenges. Physics in Medicine & Biology, Nov 28, 68(23), 23TR01.
- Rodríguez-Ruiz, A., Krupinski, E., Mordang, J. J., Schilling, K., Heywang Köbrunner, S. H., Sechopoulos, I., Mann, R. M. (2019). Detection of breast cancer with mammography: effect of an artificial intelligence support system. Radiology, Feb, 290(2), 305-14.
- Morris, E. A., Comstock, C. E., Lee, C. H., Lehman, C. D., Ikeda, D. M., Newstead, G. M. (2013). ACR BI-RADS® magnetic resonance imaging. ACR BI-RADS® atlas, breast imaging reporting and data system, 5.
- Sechopoulos, I., Teuwen, J., Mann, R. (2021). Artificial intelligence for breast cancer detection in mammography and digital breast tomosynthesis: State of the art. Seminars in cancer biology, Jul 1, 72, 214-225. Academic Press.
- Chidambaram, A., Prabhakaran, R., Sivasamy, S., Kanagasabai, T., Thekkumalai, M., Singh, A., Tyagi, M. S., Dhandayuthapani, S. (2024). Male breast Cancer: current scenario and future perspectives. Technology in Cancer Research & Treatment, Jul, 23, 15330338241261836.
- Du, Y. R., Wu, Y., Chen, M., Gu, X. G. (2018). Application of contrast-enhanced ultrasound in the diagnosis of small breast lesions. Clinical hemorheology and microcirculation. Nov 28, 70(3), 291-300.
- Wu, G. G., Zhou, L. Q., Xu, J. W., Wang, J. Y., Wei, Q., Deng, Y. B., Cui, X. W., Dietrich, C. F. (2019). Artificial intelligence in breast ultrasound. World Journal of Radiology, Feb 28, 11(2), 19.
- D’Angelo, A., Portaluri, A., Caprini, F., Sofia, C., Ferrara, F., Condorelli, E., Iaccarino, L., Catanzariti, F., Mancino, M., Trombadori, C. M., Belli, P. (2022). Male breast: a review of the literature and current state of the art of diagnostic imaging work-up. Diagnostics, Jan, 13(24), 3620.
- Braunstein, G. D., Anawalt, B. D., Post, T. W. (2020). Epidemiology, pathophysiology, and causes of gynecomastia. UpToDate. Waltham, MA: UpToDate.
- Hurwitz, D. J., Davila, A. A. (2022). Contemporary management of gynecomastia. Clinics in Plastic Surgery, Apr 1, 49(2), 293-305.
- Badu-Peprah, A., Adu-Sarkodie, Y. (2018). Accuracy of clinical diagnosis, mammography and ultrasonography in preoperative assessment of breast cancer. Ghana medical journal, Dec 26, 52(3), 133-9.
- Abeelh, E. A., AbuAbeileh, Z. (2024). Comparative effectiveness of mammography, ultrasound, and MRI in the detection of breast carcinoma in dense breast tissue: a systematic review. Cureus. Apr 26, 16(4).
- Narula, H. S., Carlson, H. E. (2014). Gynaecomastia–pathophysiology, diagnosis and treatment. Nature Reviews Endocrinology, Nov, 10(11), 684-98.
- Sansone, A., Romanelli, F., Sansone, M., Lenzi, A., Di Luigi, L. (2017). Gynecomastia and hormones. Endocrine, Jan, 55, 37-44.
- Shi, Z. A., Xin, M. (2024). Endocrine Hormones and Their Impact on Pubertal Gynecomastia. Journal of Clinical Medicine, Dec 30, 14(1), 158.
- Ng, A. M., Dissanayake, D., Metcalf, C., Wylie, E. (2014). Clinical and imaging features of male breast disease, with pathological correlation: a pictorial essay. Journal of Medical Imaging and Radiation Oncology, Apr, 58(2), 189-98.
- KC Leung, A., AC Leung, A. (2016). Gynecomastia in infants, children, and adolescents. Recent patents on endocrine, metabolic & immune drug discovery, Aug 1, 10(2), 127-37.
- Paris, F., Gaspari, L., Mbou, F., Philibert, P., Audran, F., Morel, Y., Biason‐Lauber, A., Sultan, C. (2016). Endocrine and molecular investigations in a cohort of 25 adolescent males with prominent/persistent pubertal gynecomastia. Andrology, Mar, 4(2), 263-9.
- Waltho, D., Hatchell, A., Thoma, A. (2017). Gynecomastia classification for surgical management: a systematic review and novel classification system. Plastic and Reconstructive Surgery, Mar 1, 139(3), 638e-48e.
- Trinchieri, A., Perletti, G., Magri, V., Stamatiou, K., Trinchieri, M., Montanari, E. (2021). Drug-induced gynecomastia: A systematic review and meta-analysis of randomized clinical trials. Archivio Italiano Di Urologia Andrologia, 93(4), 489-96.
- Ordaz, D. L., Thompson, J. K. (2015). Gynecomastia and psychological functioning: a review of the literature. Body Image, Sep 1, 15, 141-8.
- Berger, O., Landau, Z., Talisman, R. (2022). Gynecomastia: a systematic review of pharmacological treatments. Frontiers in Pediatrics, Nov 1, 10:978311.
- Gao, Y., Goldberg, J. E., Young, T. K., Babb, J. S., Moy, L., Heller, S. L. (2019). Breast cancer screening in high-risk men: a 12-year longitudinal observational study of male breast imaging utilization and outcomes. Radiology, Nov, 293(2), 282-91.
- Hattersley, R., Nana, M., Lansdown, A. J. (2021). Endocrine complications of immunotherapies: a review. Clinical Medicine, Mar 1, 21(2), e212-22.
- Cukier, P., Santini, F. C., Scaranti, M., Hoff, A. O. (2017). Endocrine side effects of cancer immunotherapy. Endocrine-related cancer, Dec 1, 24(12), T331-47.
- Soliman, A. T., De Sanctis, V., Yassin, M. (2017). Management of adolescent gynecomastia: an update. Acta Bio Medica: Atenei Parmensis, 88(2), 204.
- Fricke, A., Lehner, G. M., Stark, G. B., Penna, V. (2017). Long-term follow-up of recurrence and patient satisfaction after surgical treatment of gynecomastia. Aesthetic plastic surgery, Jun, 41, 491-8.