Autor: Leonardo Patricio Hidalgo Briones
Tutor: Dr. Gustavo Criscuolo
Resumen
En las glándulas suprarrenales es frecuente el hallazgo de patologías tumorales benignas o malignas. Según los reportes de estudios, en los Estados Unidos se realizan alrededor de 80 millones de tomografías anuales, con una prevalencia de hallazgos de incidentalomas que varían entre el 0,6 y el 9%, y aumentan en frecuencia con la edad.
En Argentina no se cuenta con bases de datos que reflejen la cantidad de estudios tomográficos anuales que se realizan, ni mucho menos, la prevalencia en el país de estos.
Un incidentaloma suprarrenal es una masa suprarrenal detectada en imágenes no realizadas para una sospecha de enfermedad suprarrenal. Según esta estricta definición, el estudio por imágenes no se realiza para signos y síntomas potencialmente indicativos de exceso de hormonas suprarrenales (por ejemplo, feocromocitoma, síndrome de Cushing) o una sospecha de enfermedad suprarrenal, sino más bien para la evaluación de síntomas que no son sugestivos de un problema suprarrenal, como investigaciones de dolor abdominal o de espalda o por exclusión de embolia pulmonar u otra enfermedad pulmonar.
Esta definición es reconocida por la Sociedad Europea de Endocrinología y la Red Europea para el Estudio de Tumores Suprarrenales (ESE/ENSAT), y excluye las lesiones suprarrenales descubiertas durante el cribado de pacientes con síndromes hereditarios o tumores extra suprarrenales, y sabiendo que la prevalencia de cualquier enfermedad aumenta con la capacidad del observador para detectar anomalías asociadas con la enfermedad.
Las imágenes patológicas y no patológicas de las glándulas suprarrenales son unos de los hallazgos más comunes a la hora de interpretar una tomografía computada, debido a la gran caracterización tisular a la hora de evaluar esta estructura anatómica.
Palabras clave: glándulas suprarrenales, incidentaloma suprarrenal, tomografía computada técnica wash out, adenomas suprarrenales.
Introducción
En las glándulas suprarrenales es frecuente el hallazgo de patologías tumorales benignas o malignas. Según los reportes de estudios, en los Estados Unidos se realizan alrededor de 80 millones de tomografías anuales, con una prevalencia de hallazgos de incidentalomas que varían alrededor del 0,6% al 9% y aumentan en frecuencia con la edad.(1) En Argentina no se cuenta con bases de datos que reflejen la cantidad de estudios tomográficos anuales que se realizan, menos aún la prevalencia en el país de estos.
Un incidentaloma suprarrenal es una masa suprarrenal detectada en imágenes no realizadas para una sospecha de enfermedad suprarrenal. Según esta estricta definición, el estudio por imágenes no se efectúa para signos y síntomas potencialmente indicativos de exceso de hormonas suprarrenales (por ejemplo, feocromocitoma, síndrome de Cushing) o una sospecha de enfermedad suprarrenal, sino más bien para la evaluación de síntomas que no son sugestivos de un problema suprarrenal, como investigaciones de dolor abdominal o de espalda, o por exclusión de embolia pulmonar u otra enfermedad pulmonar. Esta definición es reconocida por la Sociedad Europea de Endocrinología y la Red Europea para el Estudio de Tumores Suprarrenales (ESE/ENSAT) y excluye las lesiones suprarrenales descubiertas durante el cribado de pacientes con síndromes hereditarios o tumores extrasuprarrenales,(2) y sabiendo que la prevalencia de cualquier enfermedad aumenta con la capacidad del observador para detectar anomalías asociadas a ella.
Las imágenes patológicas y no patológicas de las glándulas suprarrenales son unos de los hallazgos más comunes a la hora de interpretar una tomografía; este término fue usado por primera vez por Geelhoed y Druy.(3)
Justificación
El abordaje de los incidentalomas suprarrenales diagnosticados por tomografía es un tema relevante debido a su alta prevalencia y a los desafíos clínicos que plantean. Comprender cómo evaluar y manejar adecuadamente estos hallazgos radiológicos puede ayudar a evitar intervenciones innecesarias, reducir la ansiedad del paciente y mejorar los resultados clínicos.
La caracterización del riesgo maligno es fundamental para determinar si una lesión suprarrenal debe ser manejada quirúrgicamente o si puede ser seguida con observación. La tomografía proporciona información valiosa sobre las características radiológicas, como el tamaño, la densidad y la heterogeneidad, que pueden ayudar a diferenciar entre lesiones benignas y malignas.
En el presente estudio abordaremos sobre la incidencia de estas lesiones, y sobre la posibilidad de poder contar con datos estadísticos, y con ello realizar comparaciones con la literatura.
La justificación de este estudio se fundamenta en la necesidad de establecer enfoques claros y basados en evidencia para el manejo de estas lesiones, en el contexto de la creciente utilización de técnicas de imagen en la práctica médica.
Marco teórico y antecedentes
Anatomía de las glándulas suprarrenales
Las glándulas suprarrenales son dos órganos de color mostaza que ocupan una posición superior y un poco medial a los riñones en el espacio retroperitoneal. Tienen un peso de unos 4 gr y su tamaño fluctúa de 40 a 60 mm de longitud, 20 a 30 mm de ancho y 2 a 8 mm de grosor.
Se trata de unos de los órganos mejor perfundidos del cuerpo, con un flujo sanguíneo de 2000 mL/kg/min. El riego arterial procede de tres vasos distintos: las arterias suprarrenales superiores, que provienen de las arterias frénicas inferiores; las arterias suprarrenales medias, unos vasos pequeños que nacen en la aorta yuxta-celíaca, y las arterias suprarrenales inferiores, originadas en las arterias renales. El drenaje venoso de cada glándula suele ser único, la vena suprarrenal izquierda, que desemboca en la vena renal izquierda, y la vena suprarrenal derecha, que vierte su contenido directamente en la vena cava. Esta configuración plantea dificultad quirúrgica.
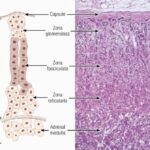
Las glándulas suprarrenales son órganos pares neuroendocrinos formados por la corteza y médula adrenal, dos estructuras claramente diferenciadas por su histología, función y origen embriológico. La corteza deriva de la cresta genital mesodérmica, igual que las gónadas y la médula de la cresta neural ectodérmica, origen común de las glándulas neuroendocrinas que forman el sistema APUD. Desde su localización original adyacente al tubo neural, las células de la cresta neural emigran en sentido ventral para adoptar una posición paraaórtica cerca de la corteza suprarrenal en desarrollo; al llegar se diferencian en las células cromafines, que constituyen la médula suprarrenal.(4,5,6)
Fisiología
La glándula suprarrenal se divide en corteza y médula.
Incidentaloma suprarrenal
Definición
Según las guías de la sociedad europea de endocrinología, un incidentaloma suprarrenal es una masa suprarrenal detectada en imágenes no realizadas para una sospecha de enfermedad suprarrenal. De acuerdo con esta estricta definición, el estudio por imágenes no se realiza para signos y síntomas potencialmente indicativos de exceso de hormonas suprarrenales (por ejemplo, feocromocitoma, síndrome de Cushing) o una sospecha de enfermedad suprarrenal, sino más bien para la evaluación de síntomas que no son sugestivos de un problema suprarrenal, como investigaciones de dolor abdominal o de espalda, o por exclusión de embolia pulmonar u otra enfermedad pulmonar.
Del mismo modo, las masas suprarrenales descubiertas en imágenes para la evaluación de tumores en neoplasias malignas extraadrenales (“estadificación tumoral” o seguimiento) no cumplen con la definición estricta de incidentaloma suprarrenal.(9)
Etiología
La etiología de los incidentalomas suprarrenales varía e incluye lesiones benignas y malignas derivadas de la corteza suprarrenal o la médula, o masas de origen extrasuprarrenales (Tabla 2). Las frecuencias reportadas varían, dependiendo del contexto del estudio y de los criterios de inclusión.
En particular, la mayoría de los pacientes con incidentalomas suprarrenales aún no se someten al ejercicio hormonal recomendado.(10)
| Adenoma supracortical o hiperplasia suprarrenal bilateral macronodular | 80%-85% |
| No funcionante | 40%-70% |
| Secreción autónoma leve de cortisol | 20%-50% |
| Aldosteronismo primario | 2%-5% |
| Síndrome de Cushing | 1%-4% |
| Otra masa benigna | |
| Mielolipoma | 3%-6% |
| Quiste y pseudoquiste | 1% |
| Ganglioneuroma | 1% |
| Schwannoma | <1% |
| Hemorragia | <1% |
| Feocromocitoma | 1%-5% |
| Carcinoma adrenocortical | 0,4%-4% |
| Otras masas malignas (principalmente metástasis suprarrenales) | 3%-4% |
Tabla tomada de directrices de práctica clínica de la Sociedad Europea de Endocrinología sobre el manejo de incidentalomas suprarrenales, en colaboración con la Red Europea para el Estudio de Tumores Adrenales.(9)
La incidencia de incidentalomas suprarrenales solo puede extrapolarse a datos encontrados en autopsias o en series de imágenes. En estudios realizados se revela que en autopsias la prevalencia de incidentalomas suprarrenales varía entre el 1% y 7% y este número podría aumentar con la edad.(11)
Los estudios radiológicos en pacientes informan que la prevalencia de los incidentalomas suprarrenales es de alrededor del 3% en adultos > 50 años y hasta un 10% en pacientes >80 años.(9)
En un estudio trabajo realizado por Song y colaboradores se encontró una prevalencia del 5% de incidentalomas suprarrenales detectados por tomografía de abdomen.(12)
Evaluación diagnóstica
Una vez encontrado el incidentaloma tenemos varias modalidades de estudio para diferenciar o caracterizarlo según su comportamiento. Hay tres técnicas principales de imagen en el uso clínico convencional: tomografía computada, resonancia magnética y tomografía por emisión de positrones con [18F] 2-desoxi-D-glucosa (en su mayoría combinadas con TC; FDG-PET/CT).
Tomografía sin contraste
Para todas las IA, se recomienda una TC sin contraste como investigación de primera línea. La evaluación de la UH en una TC no mejorada es un método para cuantificar la absorción de rayos X de los tejidos en comparación con el agua, que convencionalmente tiene una UH de 0 (Figura 1).
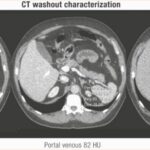
La TC sin contraste es actualmente la herramienta de imagen más fiable para los tumores suprarrenales.
Se requiere cuidado al colocar una región de interés para medir UH, esto debe cubrir al menos dos tercios de la circunferencia del nódulo mientras se evitan áreas de heterogeneidad, como la necrosis o la calcificación. Un metaanálisis reciente sobre el uso de imágenes para diferenciar las lesiones suprarrenales benignas de las malignas identificó solo dos estudios con 102 incidentes reales, basados en estrictos criterios de inclusión de metaanálisis. En pacientes sin neoplasia maligna extraadrenal conocida, una UH de ≤10 en una TC sin contraste es consistente con un adenoma benigno rico en lípidos.(13) Es importante destacar que la evaluación de UH es para lesiones homogéneas y se debe tener cuidado en lesiones heterogéneas, dada la variabilidad de UH y el potencial de perder más componentes sólidos que pueden ser malignos.
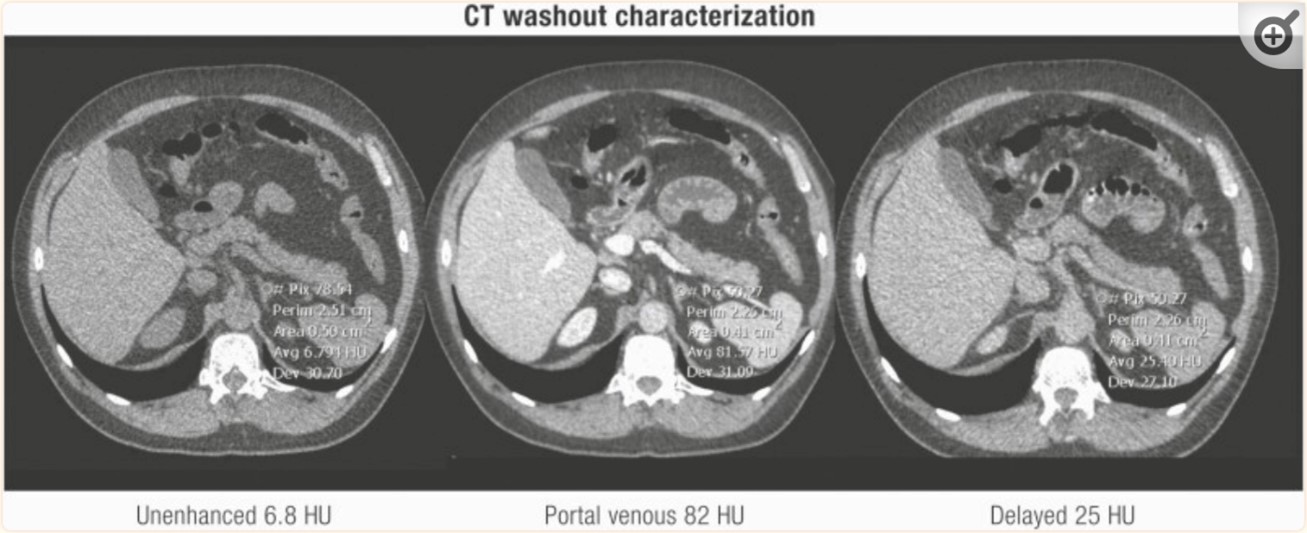
TC con contraste técnica de lavado (wash out)
Aproximadamente el 30% de los adenomas suprarrenales benignos no contienen grandes cantidades de grasa y tienen un valor de atenuación de >10 UH (es decir, adenomas bajos en lípidos); estas lesiones no se pueden caracterizar de manera confiable en tomografía sin contraste debido a una densidad superpuesta con lesiones malignas y feocromocitomas.(14, 15)
Para las lesiones con un valor de atenuación de >10 UH, se requiere una evaluación adicional y no hay un consenso claro con respecto a cuál es la mejor imagen de segunda línea para estos pacientes. Como conclusión, en un estudio realizado por Seo y colaboradores(16) se manifestó que la resonancia magnética es equivalente a la tomografía para caracterizar los adenomas que miden 20 UH o menos en la tomografía sin contraste. Sin embargo, la resonancia magnética es inferior a la tomografía para los adenomas que miden más de 20 UH debido a la disminución de la sensibilidad de la RM. En la práctica institucional realizar una tomografía computarizada dedicada al protocolo de lavado suprarrenal como siguiente prueba es más preciso para caracterizar los adenomas hipolipídicos que la resonancia magnética, aunque, como ha demostrado un metaanálisis reciente, hay necesidad de más estudios para optimizar esta técnica, ya que hay una variabilidad significativa en los protocolos de escaneo y los tiempos descritos y las sensibilidades y especificidades.
Los estudios de lavado consisten en imágenes de TC realizadas antes y en dos puntos de tiempo después de la administración de contraste intravenoso (normalmente, las imágenes se realizan a los 60-90 segundos y 10 o 15 minutos después del contraste) sin evidencia clara sobre el mejor intervalo de tiempo para el último punto de tiempo.(17) Los adenomas por lo general contrastan rápidamente y muestran un lavado rápido del contraste intravenoso, a diferencia d las lesiones suprarrenales malignas, que por lo general contrastan rápidamente pero demuestran un lavado más lento del medio de contraste.
Valores absolutos de lavado de >60% se obtienen con la siguiente fórmula: (UH contraste temprano – UH contraste retardado)/( UH contraste temprano – UH sin contraste) × 100% sugieren un adenoma benigno.(14,18)
El lavado relativo se puede calcular cuando la TC sin contraste no está disponible (UH contraste temprano – UH retardada)/ UH contraste temprano × 100%.
Los valores de > 40 % sugieren un adenoma benigno.(15,18,19)
Sin embargo, Angelelli y colaboradores evaluaron la precisión del lavado en el diagnóstico diferencial entre adenomas y no adenomas y comparar los resultados obtenidos en tomografías computarizadas retrasadas a los 5, 10 y 15 minutos; llegaron a concluir que la evaluación de los valores de TC realizadas a los 5, 10 y 15 minutos proporciona resultados de diagnóstico comparables. Por lo tanto, se prefieren las tomografías computarizadas realizadas a 5 minutos, ya que reducen el tiempo de examen y la incomodidad del paciente.
Sin embargo, consideraron solo 50 casos, por lo que se requieren estudios prospectivos más grandes para validar el rendimiento del lavado de TC de contraste en pacientes con incidentalomas. También se requiere precaución porque, si bien los feocromocitomas por lo general muestran un lavado de contraste lento, ocasionalmente pueden imitar adenomas benignos de lípidos al mostrar un lavado rápido. Por lo tanto, después de la discusión del equipo multidisciplinario (MDT), si todavía hay una sospecha con respecto a una lesión con una UH indeterminada, se debe solicitar un escaneo adicional para garantizar que no haya más crecimiento.
La resonancia magnética
La resonancia magnética es una modalidad de imagen basada en radiación no ionizante que utiliza señales débiles de onda de radio emitidas por los tejidos del cuerpo cuando el cuerpo se coloca en un campo magnético fuerte y se aplican pulsos de radiofrecuencia. Las ventajas de la resonancia magnética sobre la TC son su falta de exposición a la radiación, la falta de medios de contraste a base de yodo y su resolución de contraste tisular superior. Los tiempos de escaneo más largos, la claustrofobia y los dispositivos incompatibles con la resonancia magnética in situ son las principales desventajas de esta. Para la diferenciación de las masas suprarrenales benignas y malignas, la técnica de resonancia magnética de la imagen de desplazamiento químico se utiliza más comúnmente. La imagen de desplazamiento químico se basa en el hecho de que, dentro de los campos magnéticos, los protones en el agua vibran a una frecuencia ligeramente diferente a la de los protones en los lípidos. Como resultado, el agua y los protones de grasa oscilan dentro y fuera de fase entre sí.
Los adenomas suprarrenales con un alto contenido de lípido intracelular generalmente pierden intensidad de la señal en las imágenes fuera de fase en comparación con las imágenes en fase, mientras que las lesiones malignas y los feocromocitomas (pero también algunos adenomas suprarrenales pobres en lípidos) que carecen de lípido intracelular permanecen sin cambios y conservan su señal.(22)
Las unidades de intensidad de la señal de RM son unidades arbitrarias, a diferencia de la TC, y por lo tanto están sujetas a numerosas variaciones técnicas. La evaluación visual simple de la pérdida de intensidad de la señal es diagnóstica en la mayoría de los casos, reservando los métodos cuantitativos a casos menos claros. Las directrices más recientes sugieren que la evaluación de la resonancia magnética de las lesiones suprarrenales debe usarse principalmente como una herramienta de resolución de problemas.
La resonancia magnética con imágenes de cambio químico solo debería ser la primera opción donde la TC es menos deseable, por ejemplo, durante el embarazo, en niños o para pacientes con alergias al contraste yodado.(23)
El uso de la resonancia magnética de desplazamiento químico para detectar grasa intracelular dentro de adenomas suprarrenales ricos en lípidos y diferenciarlas de otras lesiones se describió por primera vez en 1992.
Hay métodos cualitativos (análisis visual) y cuantitativos de evaluación de imágenes que implican la evaluación del cambio en la intensidad de la señal de las lesiones suprarrenales entre secuencias en fase y fuera de fase.(24)
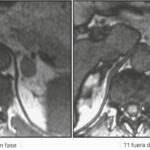
Una revisión sistemática reciente y un metaanálisis informaron que el análisis visual y el análisis cuantitativo del índice de intensidad de la señal suprarrenal y la relación suprarrenal-bajo tienen una alta precisión para la detección de adenoma rico en lípidos (95%-98%), y el rendimiento diagnóstico no mejora significativamente por el índice de intensidad de la señal suprarrenal o la relación suprarrenal a bajo(24) (Figura 2). En consecuencia, si se detectan IA en la resonancia magnética y los hallazgos son inequívocos para un adenoma benigno rico en lípidos, es posible que no se justifiquen más imágenes.
Tomografía por emisión de positrones (PET)
Es una modalidad de medicina nuclear que proporciona imágenes tomográficas cuantitativas después de la inyección intravenosa de un radiotrazador emisor de radiación beta más (positrón) (18-flúor) utilizado para etiquetar la 2-desoxi-D-glucosa que renderiza Fluoro-Desoxiglucosa ([18F]FDG). Tanto la glucosa como la desoxiglucosa entran en las células a través de transportadores de glucosa transmembrana y se someten a fosforilación, pero mientras que la glucosa sufre una mayor descomposición enzimática, la desoxiglucosa queda atrapada en los compartimentos intracelulares. Las células cancerosas tienen una mayor necesidad de glucosa y, por lo tanto, ingieren más glucosa y desoxiglucosa que las células normales. Sin embargo, la FDG no es un marcador específico para las células cancerosas, sino solo un marcador para aumentar el metabolismo de la glucosa. Por lo tanto, la absorción también puede aumentar en las células con un mayor requerimiento de energía debido a condiciones distintas del cáncer, por ejemplo, la infección activa.
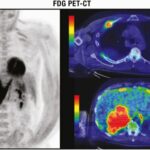
La medición cuantitativa de las concentraciones de [18F]FDG dentro de los tejidos proporciona el índice de medición clínica más utilizado, el valor de captación estándar (SUV), que compara la intensidad de la captación de 18F en la lesión suprarrenal con la captación promedio de todo el cuerpo. Los valores estándar de absorción se han utilizado para diferenciar entre lesiones suprarrenales benignas y malignas. El FDG-PET por sí solo tiene una alta sensibilidad para la detección de cambios metabólicos, pero su resolución espacial para la localización anatómica es pobre. La solución es una fusión de hardware entre PET y CT (PET/CT) que permite la adquisición simultánea de datos de PET y CT. En la práctica clínica, esto implica inyectar a los pacientes con trazadores de FDG al menos una hora antes del inicio de la PET/CT combinada. Además de su potencial de diagnóstico para discriminar entre lesiones suprarrenales benignas y malignas, la FDG-PET/CT puede ayudar, en caso de sospecha de carcinoma adrenocortical o feocromocitoma, a identificar metástasis y, en caso de sospecha de metástasis suprarrenal, a detectar el tumor primario.
Tiene una alta precisión diagnóstica para la caracterización de las masas suprarrenales con una sensibilidad agrupada del 91% y una especificidad del 91% en un metaanálisis reciente de 29 estudios en los que participaron 2421 pacientes.(25) Esta técnica es más cara y está menos disponible que la tomografía computarizada y la resonancia magnética, pero puede ayudar a discriminar la enfermedad metastásica de las masas benignas en pacientes con malignidad conocida(26) (Figura 3). Una limitación es que las lesiones suprarrenales benignas, particularmente los adenomas funcionales y los feocromocitomas no metastásicos, pueden ser FDG positivos.
Imágenes de seguimiento
Las directrices europeas sugieren que no hay que solicitar más imágenes para pacientes con lesiones suprarrenales con características benignas <4 cm de diámetro.(9) Esto está respaldado además por una reciente revisión sistemática y un metaanálisis de lesiones suprarrenales que no funcionan donde se produjo un crecimiento tumoral medio de 2 mm durante una mediana de 52,8 meses, y un agrandamiento tumoral clínicamente significativo (≥10 mm) ocurrió en solo el 2,5 % de los pacientes, y ninguno desarrolló cáncer suprarrenal.
Incidentalomas suprarrenales bilaterales
Las masas suprarrenales bilaterales pueden representar la co-ocurrencia de diferentes entidades; por lo tanto, ambas lesiones deben evaluarse por separado según las recomendaciones para una lesión unilateral.(20) Curiosamente, en pacientes con enfermedad bilateral, es posible que una masa sea un adenoma cortical no funcional, mientras que la otra masa puede ser secretora de hormonas.(27) Además, existe la posibilidad de que ambas masas (particularmente en el contexto de hemorragia y metástasis) puedan conducir a hipofunción suprarrenal y, por lo tanto, esto debe considerarse en la evaluación del paciente con incidentaloma suprarrenal bilateral.
Biopsia de la glándula suprarrenal
El número de biopsias suprarrenales se ha reducido significativamente en los últimos años debido a las mejoras en las técnicas de imagen no invasivas, que pueden diagnosticar con mayor precisión lesiones suprarrenales benignas. Hay una serie de razones para no realizar una biopsia en una lesión suprarrenal que incluye el riesgo de siembra de células cancerígenas después de la biopsia,(28) los efectos hemodinámicos adversos de realizar una biopsia en un feocromocitoma o paraganglioma no diagnosticado, y lo más importante de todo es que con frecuencia no es posible distinguir entre un adenoma suprarrenal y un carcinoma cortical suprarrenal en la muestra que se obtiene y, por lo tanto, a menudo no ayuda al proceso clínico de toma de decisiones.
En una reciente revisión sistemática y metaanálisis, Bancos y colaboradores concluyeron que una biopsia suprarrenal es más útil para confirmar el diagnóstico de metástasis del cáncer suprarrenal.(29) Solo debe llevarse a cabo después de una discusión detallada en una reunión multidisciplinaria de tumores suprarrenales y si la lesión no es concluyentemente benigna en las imágenes y, lo más importante, el resultado afectará el manejo terapéutico del paciente.
Objetivos
Objetivo general
Determinar la incidencia de incidentalomas suprarrenales en las tomografías de abdomen y pelvis realizadas en la rotación por consola en la Clínica Suizo Argentina durante el período comprendido entre julio de 2021 y julio de 2022.
Objetivos específicos
- Reconocer el motivo de solicitud por el cual se realizó el estudio tomográfico de abdomen en los pacientes a quienes se les reconoció incidentaloma suprarrenal.
- Identificar la edad y genero más frecuente de presentación de estos incidentalomas.
- Localizar la ubicación de los incidentalomas suprarrenales.
- Determinar el tamaño de la lesión y su posterior seguimiento.
- Conocer los métodos disponibles para el seguimiento de incidentalomas suprarrenales.
Metodología
Se realizó un estudio retrospectivo observacional de un total de 366 tomografías de abdomen y pelvis realizadas entre julio de 2021 y julio de 2022 en la Clínica Suizo Argentina durante el periodo de rotación en consola de tomografía.
Análisis estadístico de los resultados
Los datos se han analizado con el programa de software Microsoft Excel. Se ha realizado un análisis descriptivo de cada una de las variables por separado y se han combinado las distintas variables para buscar asociaciones entre estas basadas en porcentajes y frecuencia.
Criterios de inclusión
- Tomografías de abdomen y pelvis sin contraste y con contraste.
- Pacientes mayores de 18 años.
Criterios de exclusión
- Pedido clínico de control por algún tipo de neoplasia conocida.
- Pedido con sospecha de lesiones adrenales con alteraciones de laboratorio conocido.
- Pacientes menores de 18 años.
Resultados
Tabla 1
| N | ||
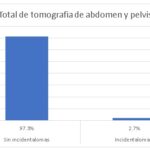
| Sin incidentalomas | 356 | 97,3% |
| Incidentalomas | 10 | 2,7% |
| TOTAL | 366 | 100% |
Gráfico 1
Se realizaron 366 tomografías de abdomen y pelvis, de las cuales 10 presentaron incidentaloma, que corresponde a un 2,7%, y 356 no presentaron incidentalomas, alcanzando un porcentaje del 97,3%.
Tabla 2
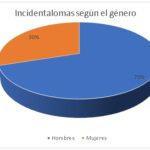
| Hombres | 7 | 70% |
| Mujeres | 3 | 30% |
| TOTAL | 10 | 100% |
Gráfico 2
De los datos obtenidos en relación con los incidentalomas observamos que el 70% corresponde al género masculino y el 30% restante al género femenino.
Tabla 3
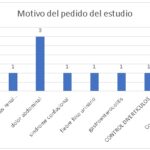
| Motivo del pedido del estudio en los pacientes con incidentaloma | |
| Hepatomegalia | 1 |
| Evaluar siluetas renal imagen en ecografía | 1 |
| Dolor abdominal | 3 |
| Síndrome confusional | 1 |
| Fiebre foco urinario | 1 |
| Gastroenterocolitis | 1 |
| Control divertículos | 1 |
| Control DM, HTA | 1 |
| TOTAL | 10 |
Gráfico 3
En el siguiente gráfico analizamos múltiples causas de motivo del pedido del estudio a los pacientes que presentaron incidentalomas suprarrenales, en el cual destaca con un 30% el dolor abdominal.
Tabla 4
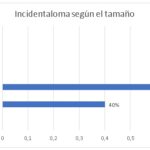
| Incidentaloma según el tamaño | ||
| 0.5 cm a 1 cm | 0 | 0 |
| 1.1 a 2 cm | 4 | 40% |
| 2.1 a 3cm | 6 | 60% |
| 3.1 cm a 3.9 cm | 0 | 0 |
| >4 cm | 0 | 0 |
| Total | 10 | 100% |
Gráfico 4
En cuanto al tamaño del incidentaloma encontramos que el rango de diámetro de 2,1 cm a 3 cm tuvo mayor porcentaje representando un 60%, los que midieron entre 1,1 a 2 cm corresponde a un 40%.
Tabla 5
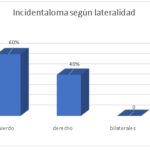
| Incidentaloma según lateralidad | ||
| Izquierdo | 6 | 60% |
| derecho | 4 | 40% |
| bilaterales | 0 | 0 |
| TOTAL | 10 | 100% |
Gráfico 5
En el siguiente gráfico observamos que, según lateralidad, el lado predominante fue el izquierdo, con un 60%, y el lado derecho alcanzó el 40%; en el presente estudio no se encontraron incidentalomas bilaterales.
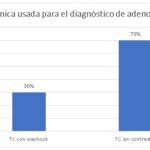
Tabla 6
| TC con wash out | 3 | 30% |
| TC sin contraste | 7 | 70% |
| TOTAL | 10 | 100% |
Gráfico 6
Se observa que el 70% de los incidentalomas suprarrenales fueron catalogados como adenomas utilizando una tomografía computarizada (TC) sin contraste. Esto indica que, en la mayoría de los casos, las características radiológicas de las lesiones permitieron una identificación clara de su naturaleza benigna sin necesidad de procedimientos adicionales. Por otro lado, el 30% restante de los incidentalomas requirió la técnica de TC con lavado para ser catalogados adecuadamente como adenomas.
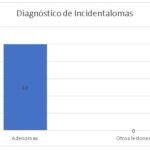
Tabla 7
| Adenomas | 10 |
| No adenomas | 0 |
Gráfico 7
Como se muestra en el Gráfico 7, encontramos que el 100% de los incidentalomas fueron catalogados como adenomas.
Conclusiones
La incidencia de incidentalomas suprarrenales en este estudio fue del 2,7%, lo que indica que, aunque es un hallazgo relativamente común en tomografías, su frecuencia es baja en comparación con otros estudios internacionales.
Se observó una mayor prevalencia en hombres (70%) en comparación con mujeres (30%), lo que podría sugerir una predisposición o un sesgo en los motivos de consulta entre los géneros.
Se destaca el dolor abdominal como el motivo más frecuente, representando el 30% de los casos. Esto sugiere que muchos pacientes que presentan incidentalomas suprarrenales pueden acudir a consulta médica por síntomas abdominales, lo que resalta la importancia de investigar adecuadamente cualquier hallazgo incidental en tomografías.
Se encontró que predominaban los incidentalomas en el lado izquierdo (60%), lo que puede ser relevante para estudios futuros sobre la anatomía y fisiología de las glándulas suprarrenales. Dado el predominio del lado izquierdo, se recomienda una vigilancia más estrecha de incidentalomas en este lado en futuros estudios.
La mayoría de los incidentalomas encontrados en este estudio tenían un tamaño entre 2,1 cm y 3 cm, lo que puede tener implicaciones en el manejo y seguimiento. Los hallazgos en este estudio indican que un porcentaje significativo de las lesiones se encuentra en un rango que podría requerir un seguimiento más cuidadoso, ya que las dimensiones pueden influir en la probabilidad de malignidad; según la Sociedad Europea de Endocrinología, se considera que tiene un mayor riesgo maligno si su tamaño es superior a 4 cm.(9)
La identificación de que el 100% de los incidentalomas fueron catalogados como adenomas refuerza la noción de que, en muchos casos, estas lesiones resultan ser benignas. Sin embargo, es esencial mantener un protocolo de seguimiento y evaluación para asegurar que no haya cambios en la naturaleza de estas lesiones a lo largo del tiempo.
No se encontraron lesiones suprarrenales malignas en la población del actual estudio.
En comparación con los trabajos encontrados en la bibliografía, Taya et al. hallaron una frecuencia del 2,3%, Song et al. del 5%, Glazer et al. del 0,6%.(12, 30, 31) En el presente estudio obtuvimos una frecuencia del 2,7%. Esta diversidad de valores puede ser producida por la resolución del equipo, la experiencia del médico al realizar el informe y la población de pacientes en centros especializados.
Recomendaciones
La caracterización y el seguimiento de los incidentalomas suprarrenales son cruciales para evitar intervenciones innecesarias, sin alterar la calidad de vida del paciente, reforzando la importancia de protocolos de manejo basados en hallazgos radiológicos.
Incluir un mayor número de participantes y considerar variables adicionales puede fortalecer la validez de los resultados y facilitar generalizaciones más amplias.
Bibliografía
- Smith-Bindman, R., Miglioretti, D. L., Johnson, E. et al. (2012). Use of diagnostic imaging studies and associated radiation exposure for patients enrolled in large integrated health care systems, 1996-2010. JAMA, 307(22), 2400-2409.
- Fassnacht, M., Tsagarakis, S., Terzolo, M., Tabarin, A., Sahdev, A., Newell-Price, J., Pelsma, I., Marina, L., Lorenz, K., Bancos, I., Arlt, W., Dekkers, OM. (2023). European Society of Endocrinology clinical practice guidelines on the management of adrenal incidentalomas, in collaboration with the European Network for the Study of Adrenal Tumors. Eur J Endocrinol, Jul 20, 189(1), G1-G42. doi: 10.1093/ejendo/lvad066. PMID: 37318239.
- Geelhoed, G. W., Dru, E. M. (1982). Management of the adrenal “incidentaloma”. Surgery, 92(5), 866-874.
- Zuluaga Gómez, A., Jiménez Verdejo, A. (2002). Patología quirúrgica suprarrenal. An urol., 2, 21-27.
- Quan Yang, D., Michael, W. Yeh (2009). Glándulas suprarrenales. En Courtney, M., Townsend, R., Daniel Beauchamp, B., Mark Evers, Mattox, K. L., Sabiston (18ª ed.). Elsevier, 997-1031.
- Mihai, R., Farndon, J. R. (2005). Surgical embryology and anatomy if the adrenal glands. Textbook of Endocrine Surgery (2nd ed.). Philadelphia, Elsevier Saunders.
- González Obeso, E., Jiménez García, Á. L. (2017). Estudio comparativo sobre la precisión de las pruebas diagnósticas preoperatorias en la determinación del tamaño tumoral, en tumores de la glándula suprarrenal. Universidad de Valladolid, Facultad de Medicina. http://uvadoc.uva.es/handle/10324/24379
- Stewart, P. M. (2003). The adrenal cortex. EnLarsen, P. R., Kronenberg, H. M., Melmed, S., Polonsky, K. S. (eds.), Williams Textbook of Endocrinology (10th ed.). Philadelphia, Saunders, 491-551.
- Fassnacht, M., Tsagarakis, S., Terzolo, M., Tabarin, A., Sahdev, A., Newell-Price, J., Pelsma, I., Marina, L., Lorenz, K., Bancos, I., Arlt, W., Dekkers, O. M. (2023). European Society of Endocrinology clinical practice guidelines on the management of adrenal incidentalomas, in collaboration with the European Network for the Study of Adrenal Tumors. European Journal of Endocrinology, 189(1), G1–G42. https://doi.org/10.1093/ejendo/lvad066
- Ebbehoj, A., Li, D., Kaur, R. J. et al. (2020). Epidemiología de tumores suprarrenales en el condado de Olmsted, Minnesota, EE. UU.: un estudio de cohorte basado en la población. Lancet Diabetes Endocrinol, 8(11), 894-902. https://doi.org/10.1016/S2213-8587(20)30314-4
- Hedeland, H., Ostberg, G., Hökfelt, B. (1968). On the prevalence of adrenocortical adenomas in an autopsy material in relation to hypertension and diabetes. Acta Med Scand, 184(3), 211-4. doi: 10.1111/j.0954-6820.1968.tb02445.x. PMID: 5703975.
- Song, J. H., Chaudhry, F. S., Mayo-Smith, W. W. (2008). The incidental adrenal mass on CT: prevalence of adrenal disease in 1,049 consecutive adrenal masses in patients with no known malignancy. AJR Am J Roentgenol, 190(5), 1163-1168.
- Boland, G. W., Lee, M. J., Gazelle, G. S., Halpern, E. F., McNicholas, M. M., Mueller, P. R. (1998). Characterization of adrenal masses using unenhanced CT: an analysis of the CT literature. AJR Am J Roentgenol, 171(1), 201-204.
- Peña, C. S., Boland, G. W., Hahn, P. F., Lee, M. J., Mueller, P. R. (2000). Characterization of indeterminate (lipid-poor) adrenal masses: use of washout characteristics at contrast-enhanced CT. Radiology, 217(3), 798-802.
- Szolar, D. H., Korobkin, M., Reittner, P. et al. (2005). Adrenocortical carcinomas and adrenal pheochromocytomas: mass and enhancement loss evaluation at delayed contrast-enhanced CT.Radiology, 34(2), 479-485.
- Seo, J. M., Park, B. K., Park, S. Y., Kim, C. K. (2014). Characterization of lipid-poor adrenal adenoma: chemical-shift MRI and washout CT. AJR Am J Roentgenol, 202(5), 1043-1050.
- Sahdev, A. (2017). Recommendations for the management of adrenal incidentalomas: what is pertinent for radiologists?Br J Radiol, 90(1072), 20160627.
- Marty, M., Gaye, D., Perez P. et al. (2018). Diagnostic accuracy of computed tomography to identify adenomas among adrenal incidentalomas in an endocrinological population. Eur J Endocrinol, 178(5), 439-446.
- Korobkin, M., Brodeur, F. J., Francis, I. R., Quint, L. E., Dunnick, N. R., Londy, F. (1998). CT time-attenuation washout curves of adrenal adenomas and nonadenomas.AJR Am J Roentgenol, 170(3), 747-752.
- Sherlock, M., Scarsbrook, A., Abbas, A., Fraser, S., Limumpornpetch, P., Dineen, R., Stewart, P. M. (2020). Incidentaloma suprarrenal. Endocr Rev, 1 de diciembre, 41(6), 775-820. doi: 10.1210/endrev/bnaa008. PMID: 32266384; PMCID: PMC7431180.
- Angelelli, G., Mancini, M. E., Moschetta, M., Pedote, P., Pignataro, P., Scardapane, A. (2013). MDCT en la diferenciación de las masas suprarrenales: comparación entre diferentes retrasos de escaneo para la evaluación del lavado intralesional. Scientific World Journal, 957680.
- Haider, M. A., Ghai, S., Jhaveri, K., Lockwood, G. (2004). Imágenes de resonancia magnéticas de desplazamiento químico de masas suprarrenales hiperatenuantes (>10 HU): ¿todavía tiene un papel? Radiología, 231(3), 711-716. https://doi.org/10.1148/radiol.2313030676
- Caoili, E. M., Korobkin, M., Francis, I. R. et al. (2002). Adrenal masses: characterization with combined unenhanced and delayed enhanced CT. Radiology, 222(3), 629-633.
- Schieda, N., Siegelman, E. S. (2017). Update on CT and MRI of adrenal nodules. AJR Am J Roentgenol, 208(6), 1206-1217.
- Kim, S. J., Lee, S. W., Pak, K., Kim, I. J., Kim, K. (2018). Diagnostic accuracy of 18F-FDG PET or PET/CT for the characterization of adrenal masses: a systematic review and meta-analysis. Br J Radiol, 91(1086), 20170520.
- Mayo-Smith, W. W., Song, J. H., Boland, G. L. et al. (2017). Management of incidental adrenal masses: a white paper of the ACR incidental findings committee. J Am Coll Radiol, 14(8), 1038-1044.
- Young, W. F. Jr. (2000). Management approaches to adrenal incidentalomas. A view from Rochester, Minnesota. Endocrinol Metab Clin North Am, 29(1), 159-85.
- Ierardi, A. M., Petrillo, M., Patella, F. et al. (2018). Interventional radiology of the adrenal glands: current status.Gland Surg, 7(2), 147-165.
- Bancos, I., Tamhane, S., Shah, M. et al. (2016). Diagnosis of endocrine disease: The diagnostic performance of adrenal biopsy: a systematic review and meta-analysis. Eur J Endocrinol, 175(2), R65-R80.
- Taya, M., Paroder, V., Bellin, E., Haramati, L. B. (2019). The relationship between adrenal incidentalomas and mortality risk. Eur Radiol, 29(11), 6245-6255.
- Glazer, H. S., Weyman, P. J., Sagel, S. S., Levitt, R. G., McClennan, B. L. (1982). Nonfunctioning adrenal masses: incidental discovery on computed tomography. AJR Am J Roentgenol, 139(1), 81-85.